【钙调素】
拼译:calmodulin,CaM
钙调素的发现是20世纪70年代自DNA重组以来分子生物学领域最重大的发现之一。CaM在生物细胞的各种过程中发挥着重要的调节作用。多年来,对这种蛋白质的研究十分活跃,为生物学开辟了一个新领域。
1967~1970年间美籍华人张槐耀研究牛脑中环磷酸腺苷(cAMP)特异的磷酸二酯酶(PDE)活性时发现CaM。起初还认为它是PDE激活剂,此后逐步认识到,它是一种具有多种调节功能的钙调节蛋白,广泛存在于生物体的真核细胞内,是细胞内信使Ca2+的重要受体,传递Ca2+对各种细胞功能调节信息。这种物质曾先后有过多种名称,1978年确定了Calmodulin的命名。1987年,中国第1次钙、钙调蛋白与细胞功能专题会议(徐州)建议将calmodulin中文译为钙调素,缩写为CaM。哺乳动物的许多组织中CaM含量丰富.大多数细胞为μM水平,其中以脑和睾丸含量最丰富.约占总蛋白含量的0.2%~0.4%。在细胞周期的不同时期,CaM分布也不相同。1986年韦尔斯(M.J.Welsh)等发现;在间期CaM主要分布在细胞质的纤维性结构上,到了前期细胞质中CaM则变为弥散状分布,前中期时CaM主要分布在半纺锤体上,中期及后期CaM转移到染色体与纺锤体极之间,而末期则只在两极有CaM分布。植物CaM般是在生长活跃、积极进行分裂的细胞中比较多,并发现CaM与植物输导组织的运输功能、植物纺锤体微管功能有关。1986年沃特朗(D.M.Watteron)等报告,牛脑的CaM具有148个氨基酸残基。该蛋白分子可分为4个区域,每个区域约包含30个氨基酸。第1区(8~40残基)与第3区(第81~113残基)排列在一起,而第2区(44~76残基)与第4区(第117~148残基)排列在一起。从原生动物四膜虫所纯化的CaM,测得它由147个氨基酸残基所组成,其氨基酸末端被乙酰化。和牛脑的CaM相比,共有11个氨基酸残基发生了取代,少了一个氨基酸残基。而菠菜的CaM序列与牛脑的CaM相比,仅13个氨基酸的区别。在生物交叉反应中,发现牛脑CaM抗体可以识别棉花种子里的CaM。表明CaM是一种进化上古老的、保守的蛋白质。CaM是一种耐热,酸性(等电点3.9~4.3),疏水性,分子量不同的球状小分子蛋白质,标准分子量为16.7KD。CaM分子上有两种结合Ca2+的部位,化学性质稳定,对多种酶结合有利。植物CaM的氨基酸组份与动物基本一致,所不同的仅在于植物有一个半胱氨酸残基,而且酪氨酸(1个)比动物中(2个)为少。CaM的吸收光谱特点是253、259、265、269、277nm处有数个吸收峰。植物与动物来源的CaM,其差别仅在于植物在277nm处吸收峰不明显。CaM的另一重要特性是可以相当专一地与一些药物结合,如某些抗精神病药物和局部麻醉剂。钙调素与这些药物结合后,就不能再与酶结合。因此,这些药物被称为CaM抑制剂,而用来探索CaM在细胞中调节功能。CaM的调节功能与Ca2+相关。CaM具有4个Ca2+结合区,在静息状态下,细胞内Ca2+浓度很低,在10-7M以下,此时CaM无活性。当细胞受到外界有效刺激后,细胞内Ca2+浓度短暂上升达10-5M,这一生物应答信号的传递以CaM为媒介。此时,CaM与Ca2+结合并使其自身的构象改变,暴露疏水区,该区能与靶酶(CaM依赖酶)相互作用,形成一个有活性的全酶。CaM的作用可概括为以下两步可逆性反应:Ca2++CaM(无活性)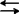 Ca2+·CaM(有活性)Ca2+·CaM+酶(无活性)
Ca2+·CaM(有活性)Ca2+·CaM+酶(无活性)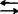 Ca2+·CaM·酶(有活性)当Ca2+浓度降低到静息水平时,CaM与Ca2+离解,酶活性亦降低到基础水平。CaM对细胞中酶的调节是多种多样的。除了在环核苷酸代谢中调节腺苷酸环化酶、磷酸二酯酶,以及在蛋白质磷酸化作用中调节需要Ca2+的蛋白激酶(PK)外,还在肌动球蛋白收缩作用中调节肌球蛋白的轻链激酶,在糖代谢中调节磷酸激酶,在Ca泵中调节Ca2+-Mg2+-ATP合成酶,在递质释放中调节需要Ca2+的蛋白激酶。CaM在突触的广泛分布和高活性,表明它对突触的功能有重要调节作用。首先它刺激突触特异蛋白质磷酸化,尤其是激活依赖CaM的蛋白激酶。CaM在细胞分裂过程中具有重要作用。在分裂中期,染色体位于赤道区时,CaM直接调节微管的聚合和解聚,从而参与染色体运动。CaM对生物的生理功能是相当复杂的,可以将其作用顺序分三步。(1)钙通道的开放。细胞膜上的受体蛋白分子接受信号后,便开启了Ca2+的载体,通道打开,Ca2+便流入细胞质内。(2)效应物蛋白的作用。在细胞质内Ca2+结合到作为效应物的专一性蛋白质CaM上,然后CaM便与专门的酶结合,从而酶活化。(3)活化蛋白质的效应。含于CaM中的Ca2+使专一性酶活化,通过序列反应,被活化的酶对靶细胞产生生理和药理学反应。在细胞核中,CaM与DNA的关系已得到初步揭示。细胞进入DNA合成期时,需要足量的CaM,表示CaM可能影响DNA的合成。在一些动物细胞中,还发现CaM拮抗剂抑制DNA的修复。暗示CaM在DNA修复过程中亦起着某种调节作用。线粒体CaM的功能目前还不大清楚,但在动物线粒体中有CaM结合蛋白,并发现CaM与线粒体的呼吸调节有关。许多CaM靶酶存在于细胞溶质部分,细胞溶质CaM可能是通过直接影响其靶酶活性或通过对蛋白质磷酸化过程的控制,而调节细胞生理过程。大量研究已证实,CaM与信息跨膜传递、血小板凝聚、癌细胞增殖、光合作用、胞内DNA的合成和皮肤纤维细胞低密度脂蛋白的合成等过程有关。CaM还参与神经递质的合成与释放,并与轴浆运输有密切的关系。可以说凡是与Ca2+有关的生理现象,几乎都与CaM有关。在疾病防治方面,如发现某种疾病的发生机制与CaM有关,就可能用CaM拮抗剂治疗这种疾病。比较成功的例子是牛皮癣病,1984年弗哈杰(A.Verhagen)等发现,牛皮癣病患者的皮肤细胞中CaM的浓度较高,而且磷脂酶A2的活性也比较高,该酶受CaM的调节。1986年汉伯特(P.Humbert)等在治疗牛皮癣的药物中加入了CaM拮抗剂氯丙嗪,收到明显疗效。几乎所有的恶性转化细胞中,CaM的含量均有大幅度增加(至少升高2倍)。在体外培养中,CaM拮抗剂可明显抑制肿瘤细胞与转化细胞的增殖。CaM不仅能促进胰岛素介导的胰岛素受体β-亚基磷酸化,而且也能激活胰岛素介导的组蛋H2B的磷酸化。胰岛素受体和CaM相互磷酸化,在胰岛素作用机制中具有重要意义。它们分别通过影响胰岛素受体蛋白激酶活性和细胞内Ca2+调节的两个主要途径,来调节细胞代谢。深入研究CaM和胰岛素受体以及蛋白激酶C之间相互关系,对于阐明含氮激素作用机理,生物信息在细胞内的传递,揭示细胞的代谢调节、生长、分化、增殖乃至癌变的本质等,都具有重要意义。CaM本身无活性,它执行生物学功能的关键在于它能够和钙调素结合蛋白(CaM-binding protein,CaMBP)结合,从而引起CaMBP生物学活性的改变,进而产生生理效应。正如通过寻找新的钙结合蛋白(CaBP)来研究Ca2+的功能一样,研究新的CaMBP已成为探索CaM未知功能的一个重要课题。【参考文献】:1 奇云.钙调素.广东生化通讯,1988,5∶107~1092 奇云.钙调素.生物学杂志,1990,1∶6~83 Mckenon T A, et al. Calcium ion improves electrophoretic transfer of calmodulin and other small proteins.
Ca2+·CaM·酶(有活性)当Ca2+浓度降低到静息水平时,CaM与Ca2+离解,酶活性亦降低到基础水平。CaM对细胞中酶的调节是多种多样的。除了在环核苷酸代谢中调节腺苷酸环化酶、磷酸二酯酶,以及在蛋白质磷酸化作用中调节需要Ca2+的蛋白激酶(PK)外,还在肌动球蛋白收缩作用中调节肌球蛋白的轻链激酶,在糖代谢中调节磷酸激酶,在Ca泵中调节Ca2+-Mg2+-ATP合成酶,在递质释放中调节需要Ca2+的蛋白激酶。CaM在突触的广泛分布和高活性,表明它对突触的功能有重要调节作用。首先它刺激突触特异蛋白质磷酸化,尤其是激活依赖CaM的蛋白激酶。CaM在细胞分裂过程中具有重要作用。在分裂中期,染色体位于赤道区时,CaM直接调节微管的聚合和解聚,从而参与染色体运动。CaM对生物的生理功能是相当复杂的,可以将其作用顺序分三步。(1)钙通道的开放。细胞膜上的受体蛋白分子接受信号后,便开启了Ca2+的载体,通道打开,Ca2+便流入细胞质内。(2)效应物蛋白的作用。在细胞质内Ca2+结合到作为效应物的专一性蛋白质CaM上,然后CaM便与专门的酶结合,从而酶活化。(3)活化蛋白质的效应。含于CaM中的Ca2+使专一性酶活化,通过序列反应,被活化的酶对靶细胞产生生理和药理学反应。在细胞核中,CaM与DNA的关系已得到初步揭示。细胞进入DNA合成期时,需要足量的CaM,表示CaM可能影响DNA的合成。在一些动物细胞中,还发现CaM拮抗剂抑制DNA的修复。暗示CaM在DNA修复过程中亦起着某种调节作用。线粒体CaM的功能目前还不大清楚,但在动物线粒体中有CaM结合蛋白,并发现CaM与线粒体的呼吸调节有关。许多CaM靶酶存在于细胞溶质部分,细胞溶质CaM可能是通过直接影响其靶酶活性或通过对蛋白质磷酸化过程的控制,而调节细胞生理过程。大量研究已证实,CaM与信息跨膜传递、血小板凝聚、癌细胞增殖、光合作用、胞内DNA的合成和皮肤纤维细胞低密度脂蛋白的合成等过程有关。CaM还参与神经递质的合成与释放,并与轴浆运输有密切的关系。可以说凡是与Ca2+有关的生理现象,几乎都与CaM有关。在疾病防治方面,如发现某种疾病的发生机制与CaM有关,就可能用CaM拮抗剂治疗这种疾病。比较成功的例子是牛皮癣病,1984年弗哈杰(A.Verhagen)等发现,牛皮癣病患者的皮肤细胞中CaM的浓度较高,而且磷脂酶A2的活性也比较高,该酶受CaM的调节。1986年汉伯特(P.Humbert)等在治疗牛皮癣的药物中加入了CaM拮抗剂氯丙嗪,收到明显疗效。几乎所有的恶性转化细胞中,CaM的含量均有大幅度增加(至少升高2倍)。在体外培养中,CaM拮抗剂可明显抑制肿瘤细胞与转化细胞的增殖。CaM不仅能促进胰岛素介导的胰岛素受体β-亚基磷酸化,而且也能激活胰岛素介导的组蛋H2B的磷酸化。胰岛素受体和CaM相互磷酸化,在胰岛素作用机制中具有重要意义。它们分别通过影响胰岛素受体蛋白激酶活性和细胞内Ca2+调节的两个主要途径,来调节细胞代谢。深入研究CaM和胰岛素受体以及蛋白激酶C之间相互关系,对于阐明含氮激素作用机理,生物信息在细胞内的传递,揭示细胞的代谢调节、生长、分化、增殖乃至癌变的本质等,都具有重要意义。CaM本身无活性,它执行生物学功能的关键在于它能够和钙调素结合蛋白(CaM-binding protein,CaMBP)结合,从而引起CaMBP生物学活性的改变,进而产生生理效应。正如通过寻找新的钙结合蛋白(CaBP)来研究Ca2+的功能一样,研究新的CaMBP已成为探索CaM未知功能的一个重要课题。【参考文献】:1 奇云.钙调素.广东生化通讯,1988,5∶107~1092 奇云.钙调素.生物学杂志,1990,1∶6~83 Mckenon T A, et al. Calcium ion improves electrophoretic transfer of calmodulin and other small proteins.(安徽省淮南职业医专奇云副教授撰)