【光敏化】
拼译:Photosensitization
是指在一光化学反应中,来自光源的光量子不是直接被反应分子吸收引起反应,而首先被作为敏化剂的分子所吸收,然后通过分子间的能量传递或电子转移,使反应物分子发生光化学反应的一种现象。由于光敏化可用以扩充光化学反应的有效吸收波长范围、提高光化学反应的效率和改善光敏材料的性能,因此,光敏化,特别是敏化机理已成为光化学中十分重要的研究课题。利用能量传递来敏化光化学反应已有较长历史。如果把Stern-Volmer对荧光猝灭的观察作为能量传递研究的开始,那么距今已有70年了。它是通过将激发的敏化剂(sen)分子能量转移给反应底物(sub)分子而实现以下反应:

为了能有效的进行能量传递,敏化剂分子应满足下列基本条件:(1)作为能量接受体的反应物分子,其激发所需的能量应小于作为能量给予体的敏化剂分子激发态的能量。这是应当满足的热力学条件;(2)被激发的敏化剂分子可通过多种途径发生衰变,回复到基态,因而具有一定的寿命。作为有效的敏化剂分子,其激发态寿命必须长到能使其能量转移至反应物分子所需时间的程度。这是敏化剂应具备的动力学条件。
根据上述基本条件可以想到:在能量传递敏化过程中,敏化剂分子三重激发态的性质是研究中的一个重要环节。由于光子能量和光的波长成反比关系,因此当敏化剂的吸收波长被扩展至较长波段时,敏化剂激发态的能量降低,在这种情况下,如反应物分子仍要求较高能量才能激发,则处于较低能位的敏化剂激发态分子就不能将能量转移给反应物分子,为此必须通过三重态和三重态间的能量转移途径。这是由于不同化合物分子单重激发态(S*)和三重激发态(T*)间的能隙是不同的。如敏化剂分子的S*态和T*间的能隙很小,即激发的敏化剂分子单重态,通过系间窜越形成敏化剂激发三重态,但其能级高度下降不多。相反,如反应的分子的S*态和T*间能隙较大,即三重激发态处于较低能位,这就可以通过下列三重态间的反应,实现敏化剂在长波长吸收条件下的能量转移:
一个典型的例子是萘和二苯酮间的能量传递,已知萘的单重激发态和三重激发态的能级高度分别为385kJ/mol及255kJ/mol,而二苯酮的则分别为301kJ/mol及289kJ/mol,如果以萘为敏化剂则可通过单重态间的能量转移将萘激发态的能量传递给二苯酮,使二苯酮分子激发,相反如以二苯酮为敏化剂则可通过三重态间的能量转移将能量转移给萘。可以看出:正是由于二苯酮单重激发态和三重激发态间的能隙甚小,因此可以实现如上述的三重态间的能量转移。必须指出:三重激发态寿命和单重态寿命相比一般较长,这就有利于能量转移的实现,即在此条件下比较易于满足敏化剂所要求的动力学条件。下表中列出的是一些常用三重态敏化剂的重要光物理参数。
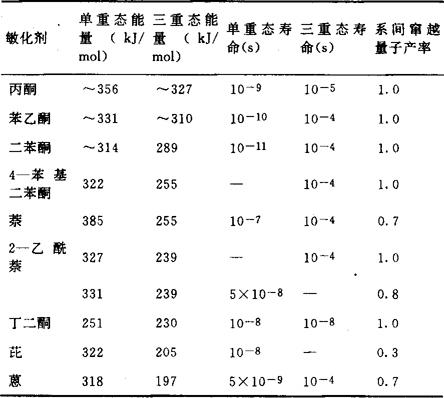
可以看到:大量的酮类化合物都有着较小的单重激发态与三重激发态间的能隙,同时又有较长的寿命,这说明为什么许多酮类化合物都可作为优良敏化剂使用的原因。能量转移光敏化过程广泛地被应用于不同的科技领域,如在作为光致抗蚀剂聚乙烯醇肉桂酸酯的光二聚化和叠氮化合物的光分解反应中,它们的敏化作用都是通过敏化剂分子的三重激发态向反应物分子进行能量转移而实现的,例如5-硝基苊,N-乙酰-4-硝基萘胺以及米蚩酮等都是聚乙烯酮肉桂酸酯光二聚的有效敏化剂,加入5-硝基苊可使其感光波长从300nm扩展至450nm,和不加敏化剂的聚乙烯醇肉桂酸酯相比感光度约提高500倍。三重态敏化剂还可以敏化产生单重态氧用来研究光氧化反应,由于基态的氧分子是三重态的,因而所用光敏化剂的三重激发态能量在大于40167kJ/mol时,就可通过能量转移产生主要为 态的单重态氧,而当敏化剂的三重态能量为22~38167kJ/mol时,则生成的仅为1Δg态的单重态氧,如下式:
态的单重态氧,而当敏化剂的三重态能量为22~38167kJ/mol时,则生成的仅为1Δg态的单重态氧,如下式:

已知一些染料如亚甲兰、曙红和孟加拉玫瑰等都是良好的产生单重态氧的敏化剂。能量转移的光敏化过程还广泛用于研究光异构化反应,光碎片化反应及光交联反应等。
利用电子转移过程敏化光化学反应是近年来迅速发展起来的一种新的敏化机制。50年代Mulliken提出电荷转移络合物的概念,指出这种两组分的络合物是由电子给体化合物和电子受体化合物通过电荷转移而形成的,当光电子给予体的电离势愈低而电子受体的电子亲合能愈高愈易于形成电荷转移络合物(CTC)。以后,Weller又发现了二甲基苯胺在光照下可生成激基复合物,并指出这是因为光诱导电子转移的结果,他们提出了如下的热力学公式:
式中ΔG是指发生在电子转移反应时,体系自由能的变化,E(D/D+)为电子给体化合物的氧化电位,E(A-/A)则为电子受体化合物的还原电位, 项是指在介电常数为ε的溶剂中将两个离子自由基导引至相距为a时体系所增加的能量,对一能自发进行光诱导电子转移反应的体系,其ΔG应为负值,反之,则不能发生光诱导电子转移。从上面的讨论中可以看出:电子转移光敏化反应和能量转移光敏化不同的是在电子转移敏化反应中不要求敏化剂有较高的激发单重态或三重态的能位,而仅要求如敏化剂为电子给体时应有较低的氧化电位,或为电子受体时应有较高的还原电位,以保证过程的ΔG为负值。正因如此,这就给要求扩展辐照波长范围的光谱敏化带来很大的方便。但是在另一方面和能量转移敏化不同的是在能量转移过程中,涉及的仅为光物理问题,即通过敏化过程后,被激发的敏化剂分子回到基态,而不会引起敏化剂发生化学变化,相反在电子转移敏化中,敏化剂可以是电子给体或电子受体,当敏化剂为电子给体时,通过电子转移就生成了敏化剂的阳离子自由基,而当敏化剂为电子受体时,则通过电子转移反应就生成了敏化剂的负离子自由基,即过程中生成了新的化学物种,它们有可能不能回复到起始的敏化剂状态。电子转移光敏化过程可以在不同的光化学反应中得到应用。例如在光氧化反应中通过电子转移可以实现对某些不易被单重态氧氧化的底物发生氧化反应,如以电子受体化合物为敏化剂则有如下反应历程使底物发生氧化。
项是指在介电常数为ε的溶剂中将两个离子自由基导引至相距为a时体系所增加的能量,对一能自发进行光诱导电子转移反应的体系,其ΔG应为负值,反之,则不能发生光诱导电子转移。从上面的讨论中可以看出:电子转移光敏化反应和能量转移光敏化不同的是在电子转移敏化反应中不要求敏化剂有较高的激发单重态或三重态的能位,而仅要求如敏化剂为电子给体时应有较低的氧化电位,或为电子受体时应有较高的还原电位,以保证过程的ΔG为负值。正因如此,这就给要求扩展辐照波长范围的光谱敏化带来很大的方便。但是在另一方面和能量转移敏化不同的是在能量转移过程中,涉及的仅为光物理问题,即通过敏化过程后,被激发的敏化剂分子回到基态,而不会引起敏化剂发生化学变化,相反在电子转移敏化中,敏化剂可以是电子给体或电子受体,当敏化剂为电子给体时,通过电子转移就生成了敏化剂的阳离子自由基,而当敏化剂为电子受体时,则通过电子转移反应就生成了敏化剂的负离子自由基,即过程中生成了新的化学物种,它们有可能不能回复到起始的敏化剂状态。电子转移光敏化过程可以在不同的光化学反应中得到应用。例如在光氧化反应中通过电子转移可以实现对某些不易被单重态氧氧化的底物发生氧化反应,如以电子受体化合物为敏化剂则有如下反应历程使底物发生氧化。

电子转移敏化还大量的应用于光敏引发聚合体系,最熟知的是二苯酮/三乙胺体系引发烯类单体的聚合,反应如下式:
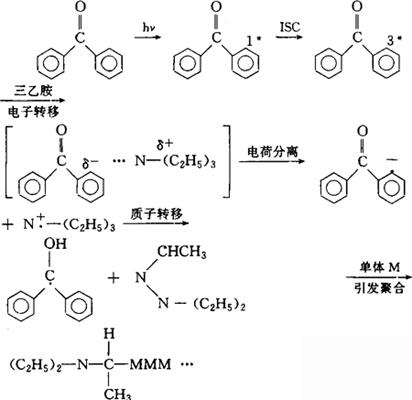
从式中可以看到:通过激发的二苯酮和三乙胺间的电子转移生成了正、负离子自由基,再经质子转移过程、产生了能引发单体聚合的活性自由基,使单体聚合。电子转移敏化反应还广泛的在光还原反应中得到应用,通过由不同色素为敏化剂所构成的多组分光还原反应体系可在太阳能光解水制氢工作中起到作用。此外,值得提到的是由能量迁移、能量传移以及电子转移等一系列过程所组成的综合的光敏化体系在自然界光合作用中起到关键的作用。
(中国科学院感光化学研究所吴世康教授、张宝文教授撰)