【电负性】
拼译:electronegativity
电负性是构成分子的原子对成键电子的吸引能力的度量。元素的电负性越大,其原子吸引电子的能力越强,在形成的分子中就得到或靠近成键电子成为负电荷的一方;相反,元素的电负性越小,其原子吸引电子的能力越弱,在所形成的分子中就失去或远离成键电子成为正电荷的一方。1932年鲍林(Pauling)首先提出电负性的概念,经化学家和物理学家长期运用与研究,其定义、计算方法、应用范围和理论根据等都得到广泛发展与成功改进。有原子、原子轨道、原子团或分子、分子轨道电负性,以及电负性均衡原理几个方面。
1932年鲍林在研究键能变化规律时发现,任何一个原子的电负性都可由含有这个原子的分子的键能或化合物生成焓等热力学数据求得。如果在AB型分子中成键电子是均等分配,则它的键能应相当于A2和B2分子的键能平均值,但实验结果几乎总是大于这种平均值。如H2和F2的键能分别为432.0和154.8kJ/mol,两者的几何平均值为258.6kJ/mol,算术平均值为293.4/mol原子,而HF键能实测值为565.0kJ/mol。鲍林用共振的观点解释为,AB分子A和B,两电负性不同,使分子在离子和共价两结构之间共振,分子的波函数表示为:ΨAB=aΨA-B+bΨA+B-+CΨA-B+,a代表共价结构A-B的成分,b和c分别代表离子结构A+B-和A-B+的成分(原子电负性前者B>A,后者A>B)。如果A-B分子是以共价键为主,离子结构的贡献要比共价结构小,a>b(或c)。由于离子结构和共价结构之间的共振,产生了共振能。共振能来源于离子结构的静电吸引力,其数值等于额外键能(Δ),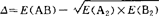 ,Δ与键的极性有关,是由于两异核原子的电负性不同导致成键后二者共用价电子不平均造成的。实验表明,A和B原子的电负性差越大,Δ值也越大。鲍林把Δ与原子的电负性联系起来,[Xp(A)-
,Δ与键的极性有关,是由于两异核原子的电负性不同导致成键后二者共用价电子不平均造成的。实验表明,A和B原子的电负性差越大,Δ值也越大。鲍林把Δ与原子的电负性联系起来,[Xp(A)-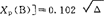 ,式中Xp(A)和Xp(B)分别为A和B原子的电负性,0.102为每摩尔千焦与电子伏特换算系数,用
,式中Xp(A)和Xp(B)分别为A和B原子的电负性,0.102为每摩尔千焦与电子伏特换算系数,用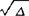 是由于它有加和性。并规定H的电负性值等于2.1为标度基础,得出其它元素电负性的相对值。饱林电负性单位是(能量)1/2,物理含意不十分明确。但电负性值可由键能的热化学或光谱数据求出,可信度较大,被广为采用。1934年密立根(Mulliken)提出用原子形成正或负离子的倾向,即原子的价态电离能(IEv)和价态电子亲合能(EAv)标度电负性。以电子伏特作单位,经验计算公式为:XM=0.168(IEv+EAv-1.23)。不同价态轨道有不同的IEv和EAv值,从而把原子价态轨道和杂化态与电负性联系起来,称为原子轨道电负性。例如:C原子以纯p轨道键合时,XM值为10.93eV;sp3杂化态时13.27eV;sp2杂化态时13.67eV;sp杂化态时14.08eV。由于s轨道较相同主量子数的其它轨道的能量低,对电子的吸引能力强,所以杂化轨道中s成分增加,电负性也增大。IEv和EAv不能直接由实验测得,但可由基态原子的电离能、电子亲合能以及价态激发能进行计算,贾菲(Jaffe)在这方面做了很多工作,因此XM也称作密立根-贾菲电负性。密立根电负性和鲍林电负性的换算关系为:Xp=0.34XM-0.2。密立根电负性值不再是分子中原子吸引电子的能力,而是根据光谱实验测得电离能和电子亲合能计算的绝对值,是中性原子本身的性质,多为化学理论研究所采用。分子中的原子可能是阴、阳离子、原子团或带部分电荷。1961年lczkowski等认为电荷对原子的电负性也有影响,原子的各级电离态的能量E与电荷(或部分电荷)q存在函数关系:E(q)=αq+βq2,α和β是系数。将电负性定义为:
是由于它有加和性。并规定H的电负性值等于2.1为标度基础,得出其它元素电负性的相对值。饱林电负性单位是(能量)1/2,物理含意不十分明确。但电负性值可由键能的热化学或光谱数据求出,可信度较大,被广为采用。1934年密立根(Mulliken)提出用原子形成正或负离子的倾向,即原子的价态电离能(IEv)和价态电子亲合能(EAv)标度电负性。以电子伏特作单位,经验计算公式为:XM=0.168(IEv+EAv-1.23)。不同价态轨道有不同的IEv和EAv值,从而把原子价态轨道和杂化态与电负性联系起来,称为原子轨道电负性。例如:C原子以纯p轨道键合时,XM值为10.93eV;sp3杂化态时13.27eV;sp2杂化态时13.67eV;sp杂化态时14.08eV。由于s轨道较相同主量子数的其它轨道的能量低,对电子的吸引能力强,所以杂化轨道中s成分增加,电负性也增大。IEv和EAv不能直接由实验测得,但可由基态原子的电离能、电子亲合能以及价态激发能进行计算,贾菲(Jaffe)在这方面做了很多工作,因此XM也称作密立根-贾菲电负性。密立根电负性和鲍林电负性的换算关系为:Xp=0.34XM-0.2。密立根电负性值不再是分子中原子吸引电子的能力,而是根据光谱实验测得电离能和电子亲合能计算的绝对值,是中性原子本身的性质,多为化学理论研究所采用。分子中的原子可能是阴、阳离子、原子团或带部分电荷。1961年lczkowski等认为电荷对原子的电负性也有影响,原子的各级电离态的能量E与电荷(或部分电荷)q存在函数关系:E(q)=αq+βq2,α和β是系数。将电负性定义为: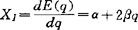 ,并证明这种电负性标度与密立根电负性是一致的。当电荷为0时,XI=α即等于中性原子的密立根电负性值。2β称为电荷系数,用以衡量电负性随电荷改变的速率。大而软(易极化)的原子的β值较低,小而硬(难极化)的原子的β值较高。Iczkowski把原子上的部分电荷看作一个连续可变函数,反应了分子中原子电荷迁移的非整数性,并隐含了电负性是能量的密度泛函变化率的性质。1964年麦克丹尼尔(Mcdaniel)等从热化学循环半经验地得到酸根的电负性XL、电离常数PKa及氧化电位E°之间满足如下关系:0.059PKa-E°=(XL-XH)2,其中XH表示氢原子的电负性。1965年Huheey认为原子团的电负性由具有自由价中心原子表现出来。1976年扬金(Younkin)等的实验证明共轭有机体系的电子亲合能EAv与分子的最低空轨道的能级ε1umo相关。EAv=-ε1umo--δ,其中δ为改组能。最高占领轨道的电离能IEv类同于上式。所以根据密立根电负性经验式,可由前线轨道能量平均值来计算共轭分子的电负性。1977年约翰逊(Johnson)定义分子轨道电负性等于该轨道能量εi的负值:
,并证明这种电负性标度与密立根电负性是一致的。当电荷为0时,XI=α即等于中性原子的密立根电负性值。2β称为电荷系数,用以衡量电负性随电荷改变的速率。大而软(易极化)的原子的β值较低,小而硬(难极化)的原子的β值较高。Iczkowski把原子上的部分电荷看作一个连续可变函数,反应了分子中原子电荷迁移的非整数性,并隐含了电负性是能量的密度泛函变化率的性质。1964年麦克丹尼尔(Mcdaniel)等从热化学循环半经验地得到酸根的电负性XL、电离常数PKa及氧化电位E°之间满足如下关系:0.059PKa-E°=(XL-XH)2,其中XH表示氢原子的电负性。1965年Huheey认为原子团的电负性由具有自由价中心原子表现出来。1976年扬金(Younkin)等的实验证明共轭有机体系的电子亲合能EAv与分子的最低空轨道的能级ε1umo相关。EAv=-ε1umo--δ,其中δ为改组能。最高占领轨道的电离能IEv类同于上式。所以根据密立根电负性经验式,可由前线轨道能量平均值来计算共轭分子的电负性。1977年约翰逊(Johnson)定义分子轨道电负性等于该轨道能量εi的负值: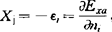 ,式中Exa是体系总能量,ni是i轨道占领数。1968年克洛普曼(Klopman)用微扰分子轨道方法,得到酸碱类分子轨道电负性。电负性的静电标度法表达式很多,其本质都是将电负性作为原子电荷和半径的函数,以体现原子在分子中吸纠电子能力这一物理意义。1957年李世瑨提出
,式中Exa是体系总能量,ni是i轨道占领数。1968年克洛普曼(Klopman)用微扰分子轨道方法,得到酸碱类分子轨道电负性。电负性的静电标度法表达式很多,其本质都是将电负性作为原子电荷和半径的函数,以体现原子在分子中吸纠电子能力这一物理意义。1957年李世瑨提出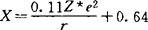 ,表明电负性随有效核电荷Z*增加而增大;随单价离子半径增大而减小。1958年奥尔雷德一罗周(Allred-Rochow)提出直接用原子核对键合电子的静电引力
,表明电负性随有效核电荷Z*增加而增大;随单价离子半径增大而减小。1958年奥尔雷德一罗周(Allred-Rochow)提出直接用原子核对键合电子的静电引力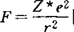 [Z*是用斯莱特(Slater)规律确定的有效核电荷]衡量电负性大小,
[Z*是用斯莱特(Slater)规律确定的有效核电荷]衡量电负性大小,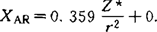 744,r为单键共价半径,发现
744,r为单键共价半径,发现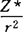 值和鲍林电负性值有直线关系。1960年利特尔(Little)等对XAR值作了补充计算。1974年温元凯改进了屏蔽常数的计算方法,提出
值和鲍林电负性值有直线关系。1960年利特尔(Little)等对XAR值作了补充计算。1974年温元凯改进了屏蔽常数的计算方法,提出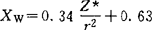 ,所得电负性值与鲍林值比较接近。XAR和Xw标度把元素的电负性与分子中原子的两种基本性质参数Z*和r联系起来,充分体现了电负性不是孤立的基态原子的性质,而是受其周围原子的环境所影响这一物理图象。1952年桑德森(SanderSon)发现原子的电子密度
,所得电负性值与鲍林值比较接近。XAR和Xw标度把元素的电负性与分子中原子的两种基本性质参数Z*和r联系起来,充分体现了电负性不是孤立的基态原子的性质,而是受其周围原子的环境所影响这一物理图象。1952年桑德森(SanderSon)发现原子的电子密度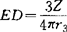 (Z为原子序数,r为共价半径)随其电负性值而改变。提出用原子的ED值除以等电子惰性气体元素的ED′值作为电负性标度(Xs),桑德森电负性值与鲍林值的关系是:Xp=(0.25Xs+0.77)2。桑德森电负性较成功地讨论许多问题,在现代化学中应用较广,是颇有发展前途的一种标度法。1952年桑德森提出电负性均衡原理,认为若原子A的电负性大于B,当A、B沿反应坐标接近至发生相互作用时,B将有部分电荷向A迁移,使A的有效核电荷减小,降低它的电负性;相反,B由于失去部分电荷而增加其有效核电荷,升高它的电负性。成键原子自动调整各自电负性的初始值,直至电负性趋于均等。1978年帕尔(Parr)和波利策(Pollitzer)等根据量子化学计算结果也得出相同结论,并被理论化学工作者普遍接受。这一原理的重要性在于它指出了键电荷迁移的动力、方向和限度,有助于了解键合过程中的机制,并为用电负性定量地处理化学问题提供了条件。【参考文献】:1 鲍林著.化学键的本质.卢嘉锡等译.上海:上海科学技术出版社,1966.792 Huheey J E. Inorganic Chemistry,2nd ed, New York, 1978, 160~1733 Bratsch S G. J Chem Educ, 1933,65(1) : 34~414 Sanderson R T. J Chem EDuc, 1988,65(2) : 112~1185 Sanderson R T. J Chem Educ, 1988,65(3): 227~2316 孙家跃,石春山.化学通报,1990,11∶1~10
(Z为原子序数,r为共价半径)随其电负性值而改变。提出用原子的ED值除以等电子惰性气体元素的ED′值作为电负性标度(Xs),桑德森电负性值与鲍林值的关系是:Xp=(0.25Xs+0.77)2。桑德森电负性较成功地讨论许多问题,在现代化学中应用较广,是颇有发展前途的一种标度法。1952年桑德森提出电负性均衡原理,认为若原子A的电负性大于B,当A、B沿反应坐标接近至发生相互作用时,B将有部分电荷向A迁移,使A的有效核电荷减小,降低它的电负性;相反,B由于失去部分电荷而增加其有效核电荷,升高它的电负性。成键原子自动调整各自电负性的初始值,直至电负性趋于均等。1978年帕尔(Parr)和波利策(Pollitzer)等根据量子化学计算结果也得出相同结论,并被理论化学工作者普遍接受。这一原理的重要性在于它指出了键电荷迁移的动力、方向和限度,有助于了解键合过程中的机制,并为用电负性定量地处理化学问题提供了条件。【参考文献】:1 鲍林著.化学键的本质.卢嘉锡等译.上海:上海科学技术出版社,1966.792 Huheey J E. Inorganic Chemistry,2nd ed, New York, 1978, 160~1733 Bratsch S G. J Chem Educ, 1933,65(1) : 34~414 Sanderson R T. J Chem EDuc, 1988,65(2) : 112~1185 Sanderson R T. J Chem Educ, 1988,65(3): 227~2316 孙家跃,石春山.化学通报,1990,11∶1~10(抚顺石油学院孙家跃教授撰;孙桂大审)