【半导体光催化】
用半导体粒子作光催化剂早已有报道,但在A.Fujishima(1972)用半导体作光电极分解水及A.J.Bard(1979)将光电化学理论扩展到半导体微粒光催化剂的报道发表之后,半导体光催化才有很大的发展,从太阳能利用的观点来看,半导体光催化有着重大的应用前景,它不仅能生产有用的物质,如光解水制氢、光催化有机合成,而且还能降解有毒物质,处理废水,节约能源等,它是将太阳能转换为化学能的一个重要途径。
半导体光催化的特征 把分散在溶液中的每一颗半导体粒子近似地看成是一个小型短路的光电化学电池,可以用光电化学的基本理论来阐明光催化反应机理,当用能量大于能带隙的光照射到半导体分散体系时,半导体粒子吸收光产生电子-空穴对时,在电场的作用下电子与空穴分离,分别迁移到粒子表面的不同位置,与溶液中相应的组分进行氧化与还原反应,若总反应的自由能变化小于零,光能用以克服反应的活化能,这是光催化反应;若总反应的自由能变化大于零,反应中吸收光能转换为化学能储存,这是光电解,统称为光催化反应。由于半导体光催化过程是按光电化学反应进行的,故又称为光电催化反应。物质能否在半导体界面进行光催化反应,是由该物质的氧化还原电位和半导体能带位置所决定的,半导体价带的能级代表该半导体空穴的氧化电位的极限,任何具有氧化电位在半导体价带位置以上的物质,原中央电视台上都可以被光生空穴氧化;同理,任何具有还原电位在半导体导带以下的物质都可以被光生电子还原。半导体光催化系的实验装置简单,光吸收效率高,适用于电解质、非电解质及水和有机溶液体系,因此,光催化体系的范围较为广泛,此外半导体光催化还有以下特性。催化剂粒子和吸附。分散在溶液中的半导体粒子尺寸小,可以从几微米(μm)到几个纳米(nm),由于粒子小,单位质量的粒子数目多,光吸收效率高,不易达到光吸收饱和的程度;体系的比表面积大,反应面积就大,同时也有利于反应物的吸附,董庆华等(1989)的实验结果表明,在光催化反应中,反应物吸附在催化剂的表面是光催化反应的一个前置步骤,催化反应的速率与该物质在催化剂上的吸附量有关,吸附效应甚至允许光生载流子优先与强吸附的物质进行反应,不管溶液中其它物质的氧化还原电位顺序。催化剂的活性。计算表明,在粒径为1μm的TiO2粒子中电子从体内扩散到表面的时间约需100ns,而粒径为10nm的微粒中只需10ps,因此,粒径越小,电子与空穴复合几率越小,电荷分离效果就越好。在分解水的实验中,TiO2粒径小,产氢量高。半导体上担载金属或金属氧化物可提高光催化活性,担铂的TiO2催化分解水产氢的活性比末担铂的提高一个数量级,活性提高的原因是降低催化剂上析氢超电势和增加电荷分离效率。P.Pichet(1987)研究了担金属的氧化物半导体表面性质、催化活性和选择性,说明这些性质与金属和半导体两者的催化性质和相互作用有关,吴越(1987)按照金属与半导体之间形成结的性质,分析了金属对半导体表面进行的光催化反应可能具有的效应。Nakamatu报道TiO2表面担铂,铂粒子之间的距离在100nm左右产氢量最高,中户羲(1990)研究在半导体表面担载超微粒金属且金属粒子之间有一定距离,催化效果最好。催化剂的选择性。由于光催化剂粒子小,表面氧化和还原的位置距离就很近,因此催化反应的途径与在电极分离的电池不同。例如TiO2与铂电极组成电池,光分解醋酸,生成乙烷和CO2而Pt/TiO2粒子催化分解的产物是甲烷和CO2,因为微粒上氧化和还原的位置很近,氧化的产物CH3自由基立即与还原的产物氢结合,生成甲烷。不同种类的半导体催化反应的选择性也不同。用Pt/TiO2和Pt/CdS催化分解乳酸,前者分解产物是H2、CO2、和CH3CHO,而后者分解产物是H2和CH3COCOOH。光照下半导体粒子电位的浮动效应。半导体分散系中一个特殊的性质是粒子的电位可以变动。按照半导体在溶液中能带的位置,TiO2的导带电位不足以还原氢,因此,在光电化学电池中不.加偏压是不能析出氢的;但在TiO2粒子上可收集到氢。W.W.Dunn(1983)用泥浆电极法测量了溶液中半导体粒子的电化学性质,测出在醋酸溶液中TiO2粒子的电位在光照下是浮动的,粒子的电位负移0.4V,提高了TiO2的电子能级,因此可以还原氢。同样的理由,In2S3、Fe2O3、MoS2催化剂粒子也可还原氢。半导体粒子小于100nm就是胶体,胶态半导体体系的特点是它可以透过可见光及紫外光,因此可用近代的光化学方法研究光催化过程中的电荷转移、中间产物的生成、催化反应的动力学和反应机理,这对理解光催化过程是非常重要的。纳秒(ns)和皮秒(ps)激光闪光光解技术是探测半导体中电荷的捕获和复合的方法,结果表明,电子和空穴的捕获是很快的过程,在胶态TiO2中电子的捕获在30ps内完成,空穴较慢,约于250ns左右完成。ESR对锐钛矿型TiO2粒子研究表明,电子和空穴分别被捕获在Ti4+和邻近表面的氧化物离子的位置。紫精类化合物常用于探测界面电荷转移,还原态的紫精可用吸收光谱检测。M.Gratzel(1982)研究了胶态体系中H+浓度对还原甲基紫精的影响,在较低H+浓度时,胶态半导体上多相电子转移的动力η=EcB-EA0/A
其中EcB是导带的能级, 是电子受体的标准还原电位。Brown、Mulveney等研究了胶态氧化物周围的电位分布及还原物质的电荷对电子转移速率的影响,说明调节溶液的H+浓度值和离子强度可以控制表面电位,使它有利于界面电荷的转移。P.V.Kamat(1985)用激光闪光光解研究了噻嗪、和吩嗪在TiO2和CdS胶体的还原过程。
是电子受体的标准还原电位。Brown、Mulveney等研究了胶态氧化物周围的电位分布及还原物质的电荷对电子转移速率的影响,说明调节溶液的H+浓度值和离子强度可以控制表面电位,使它有利于界面电荷的转移。P.V.Kamat(1985)用激光闪光光解研究了噻嗪、和吩嗪在TiO2和CdS胶体的还原过程。

 可从吸收光谱验证,T.Moser等(1981),研究了卤素离子CI-、Br-、I-在胶态TiO2、CdS及In2S3上的氧化。卤素离子在TiO2上的氧化效率与它们的氧化电位有关,还研究了若干有机化合物如丙醇,半胱胺酸及甲基橙在半导体上的氧化过程。当溶液中缺少与光电子或空穴反应的物质时,过剩的载流子与半导体进行反应,引起光腐蚀,例如在含空气的CdS体系中,CdS受到光阳极腐蚀,其反应如下:
可从吸收光谱验证,T.Moser等(1981),研究了卤素离子CI-、Br-、I-在胶态TiO2、CdS及In2S3上的氧化。卤素离子在TiO2上的氧化效率与它们的氧化电位有关,还研究了若干有机化合物如丙醇,半胱胺酸及甲基橙在半导体上的氧化过程。当溶液中缺少与光电子或空穴反应的物质时,过剩的载流子与半导体进行反应,引起光腐蚀,例如在含空气的CdS体系中,CdS受到光阳极腐蚀,其反应如下:
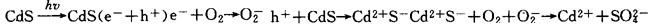
氧促进CdS的阳极腐蚀,如果排除体系中的氧则会抑制CdS的光阳极腐蚀;反之,若溶液中存在与电子反应的物质如甲基紫精,而溶液中又无适当的物质与空穴反应则会加强CdS的阳极腐蚀。若溶液中存在空穴清除剂而又无适当物质与电子反应,则表面剩余的电子也会引起CdS的光阴极腐蚀,腐蚀产物为金属镉。
当半导体粒子尺寸小于50nm以下,粒子显出与单晶半导体不同的光学和电学性质。例如CdS粒子大于50nm,它的吸收光谱阈值为515nm(相应CdS能带隙为2.4eV),随着粒子尺寸减小,吸收光谱发生变化,吸收光谱阈值逐渐向短波移动。反映CdS的能带隙在增大,仔细地测量了CdS、ZnO和PdS的吸收波长阈值和能带隙与粒子尺寸的关系,能带隙小的半导体吸收波长的变化较为显著。单晶砷化镉为黑色(能带隙为0.5eV),制备粒径10到2nm的砷化镉微小粒子,得到所有可见光的颜色。又如胶态CdS的荧光为桔黄色,随着粒子尺寸减小,CdS胶体荧光变为绿色。这些直超细微粒子具有与单晶半导体不同性质的原因是由于粒子减小而量子化的结果。半导体的载流子限制在一个小尺寸的势阱中,有些条件下,导带和价带能级变成分离的能级,因而能带隙增大,吸收光谱阈值向短波方向移动,这种效应称为尺寸量子效应,这种具有与尺有关的光学和电学性质的粒子称为量子化粒子,简称Q-粒子。量子力学计算表明,在这种情况下能带隙移动等于h2/8m*cR2,其中m*c是载流子的有效质量,R是粒子的半径,载流子的有效质量越小,尺寸量子效应越显著。尺寸量子效应的研究在物理中很活跃,这种效应对化学性质的影响也逐渐被化学家所重视。Henglein等成功地制备了各种超细胶态半导体,如CdS、Cd3P2、Cd3As2等,这些胶态粒子的光吸收从可见光到近红外光,已经表明,这种超细微粒子对光催化反应有明显的影响。H.Miyoshi(1990)研究胶态氧化铁粒子,它们的能带隙随粒子减小而增大,导带能级向负移,价带能级也以相同的速动向正移,光电流起始电位由-0.050V移到-0.75V(Vs,SCE),由于尺寸量子效应使半导体导带移向更负的电位和价带移向更正的电位,这必然加强半导体光催化剂的氧化和还原能力,提高光催化活性。A.Fojtik(1984)报道CdS的粒子尺寸减小,光阳极腐蚀减少,在溶液中稳定性增大,光阳极腐蚀减少的原则是与空穴竞争的反应(如氧化溶剂)速度增加有关。将两种不同的半导体粒子联起来就成为一种夹心结构的半导体胶体,一边为能带隙较小的半导体,一边为能带隙较大的半导体,例如CdS和TiO2或CdS和ZnO体系,当光照在能带隙小的半导体上则会对另一半导体有响应,例如CdS胶体有荧光,加入TiO2后,随TiO2的浓度增大而CdS荧光减弱,催化剂还原甲基紫精的能力则随TiO2浓度增大而增强,产生这个效应是因为CdS吸收光产生电子-空穴对,电子跃迁到导带并立即转移到TiO2的导带,而空穴有能转移我,因此增加电荷分离效率,CdS/TiO2的光催化活性则比单一CdS提高得多,类似的效应在Cd3P2/ZnO夹心结构胶体中也观察到,而且随着Cd3P2粒径减小,它的导带能级越负,电子从Cd3P2转移到ZnO的驱动力就越大。由于尺寸量子效应有可能调节半导体的粒径来控制半导体的能带隙大小和能带的位置,它将对半导体光催化反应带来重大的影响。光催化的应用 光催化分解水。在光催化反应中研究得最多的是光催化分解水,TiO2和SrTiO3在水溶液中化学稳定性好,但它们的带隙太宽,太阳能利用效率低,与太阳光谱相匹配的半导体如CdS、CdSe在水溶液中发生光腐蚀,虽然研究过在半导体表面担载金属和金属氧化物,或在半导体表面修饰一层光敏剂或在溶液中加入光敏剂或牺牲剂,但完全分解水的效率仍是很低的。效率低的另一原因是氧化产物与还原产物之间发生逆反应,堂免一成(1989)提出一种层状结构担镍的铌酸盐(Ni/Rb4Nb6O7)的新型催化剂,在紫外光照下(330nm)分解水的量子效率达10%。但这种催化剂只能吸收紫外光,还需要进一步改进,研究适合于太阳能分解水的新光催化剂。光催化合成反应。半导体催化用于有机化合物最初的例子是-Kolb反应,B.Kraeutler(1977,1979)用Pt/TiO2催化剂使醋酸脱羧生成甲烷,用TiO2催化分解醇的水溶液产生氢,顾婉贞以ZnS为催化剂,用甲醇作底物,光催化产氢,同时合成乙二醇或丁二醇,在甲醇和乙醇的混合溶液中产氢及合成丙二醇。M.A.Fox(1983)用TiO2为催化剂在含氧的有机溶剂中,光催化分解萘化合物,生成邻位取代苯化物,所得产物的收率较高,光催化成为制备邻位取代苯化合物的一种方法,Toumaru在含氧和二氧化钛的有机溶剂中光催化1,1-二苯基乙烯,反应生成1,1-二苯基环氧和苯酮等化合物,Hama研究了胺的光催化氧化,氧化甲苯胺生成偶氮化物,光催化反应产物与反应条件(如胺的超始浓度,半导体种类等)有关。半导体光催化合成的另一例,是在有氨、甲烷和Pt/TiO2的水溶液中合成氨基酸。光催化氧化无机物和分解氧化有机物。由于光照半导体产生的空穴和电子具有很强的氧化和还原能力,能氧化有毒的无机物和降解大多数有机物,将它们最后分解、氧化成为CO2、H2O和简单的无机物,因此,利用太阳能光催化分解无机和有机物的方法受到重视。B.Kraeutler(1977)用TiO2光催化氧化水中CN-及卤素离子,E.Borgarello(1982)用CdS光催化氧化H2S成为单质硫,量子产率约50%,J.M.Herrman(1983)用各种半导体粒子光催化分解草酸(存在纺织工业废水中),其中以TiO2最稳定,光催化活性最高,蔡乃才(1988)研究了各种有机羧酸在Pt/TiO2上的分解速率与分子结构的关系。K.Hashimato(1984)用Pt/TiO2光催化分解水中各种碳氢化物C.Y.Hsiao(1983)首先报道用TiO2光催化分解有害的卤代烯烃,最终产物是CO2、H2O和无机酸,后来陆续报道了用半导体光催化方法分解酚、卤代芳香族化合物、二乙基硝基苯磷酸盐、表面活性剂、金属有机化合物以及有机磷农药等等。在这些报道中,光催化剂在多是用TiO2,因为它在水中稳定,它的价带的电位很正,光生空穴几乎可以氧化所有的有机基团,最后将它们完全分解,成为无害的物质,由于光催化分解水中有毒污染物的方法简便,又能避免通常化学方法处理水带来的二次污染问题,因此研究用太阳能作能源,光催化分解有害的废弃物质、处理水中污染物,净化水质的应用试验正在开展,据报道美国能源部所属桑迪亚国家实验室试验成功以太阳能作动力的净化污染水的解毒处理系统,美国伯尔得公司太阳能研究所采用集束太阳能破坏水中有机污染物,效果较好。考虑到光激发半导体有较强的氧化能力,松永足(1985)提出用TiO2分散体系的杀菌方案,杀死酵母菌和大肠杆菌,A.Fujishima有TiO2杀HeLa细胞,川合用半导体粒子制备超纯水,这都是一些新的研究方向。人们对半导体催化已进行了广泛的研究,在某些方面已展示出它的特点和应用前景,但是还存在着能量转换效率不高和发生光腐蚀等问题,需要进一步开展研究,并向实际应用方面发展。(武汉大学化学系董庆华撰)