【逆转录病毒长末端重复序列的结构和功能】
自1970年 Temin和Baltimore首次发现逆转录酶后,逆转录病毒的名字才被广泛采用,而且关于此类病毒复制的假说也被普遍接受,即由逆转录酶将病毒的RNA逆转录成DNA后整合到宿主细胞染色体上,整合的病毒DNA在宿主细胞RNA聚合酶Ⅱ的作用下转录成RNA,此RNA可作为子代病毒核酸被包装在病毒粒子内,或进一步剪接成mRNA再翻译成病毒蛋白。
逆转录病毒分布广泛,几乎各种动物都有感染。与大多数其它类型的动物病毒不同的是逆转录病毒感染很少导致细胞的破坏,一旦感染即可终身带毒,有些还可直接或间接导致肿瘤。逆转录病毒的这些特征与其前病毒DNA上的长末端重复序列(LTR)有密切的关系。逆转录病毒的RNA和其复制中间体DNA的末端都含重复序列,但互不相同。在DNA末端含有一段非常小的重复序列(8~247个核苷酸),称为r系列,而病毒DNA的两末端都有一长末端重复序列。不同的逆转录病毒LTR都是U3、R和U53个区域组成,但大小不一。RNA末端的重复序列对于病毒DNA的合成起重要作用,而病毒DNA的LTR对于病毒DNA的整合必不可少,并控制病毒RNA的转录,具有转录启动子等作用。逆转录病毒RNA分子的5′末端有一帽子结核,其后是一段长为8~247个核苷酸的系列(r),此系列在病毒RNA的3′末端重复出现,紧接着5′端r系列的是另一长为55~203个核苷酸的U5系列,在3′端与r系列相邻的是U3区域,大小为187~1194个核苷酸。在以病毒RNA为模板进行逆转录时,先从5′末端拷贝U5和R系列,此系列(DNA形式)被转移到3′末端,R系列与r系列结合作为引物再拷贝3′端的U3区,这样逆转录形成的U3-R-U5系列(即为LTR)作为模板合成另一拷贝的LTR,然后转移到病毒DNA的5′末端。在病毒RNA5′末端U5系列之后是两个UMP残基(对鼠乳腺瘤病毒是GMP和CMP残基),接着就是18~21个碱基的系列,这一区域与对不同逆转录病毒具有特异性的一种细胞tRNA3′端的核苷酸链是互补的。这种细胞tRNA是病毒负链DNA合成时的引物,目前已知的引物tRNA有赖氨酸(Lys),脯氨酸(Pro)和色氨酸(Trp)。整合的前病毒两末端都有LTR,而且排列方向相同,在每个LTR中,两极端的核苷酸是相互反向重复的,所以整个病毒DNA实际上也具有末端反向重复序列。对于同一逆转录病毒来说,不同毒株的LTR的核苷酸系列和大小是相似的,但不同病毒之间有很大差异。系列分析结果证明各逆转录病毒的LTR之间也有一定的同源系列存在,这些同源系列可能对前病毒的整合以及病毒的RNA合成的控制起重要作用。LTR末端的反向重复序列大小在3~16碱基对之间,所在整合的前病毒LTR的末端都是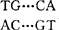 ,除MMTV外,所有未整合的病毒DNA末端反向重复序列都比整合的前病毒多2个碱基对。在LTR的R区前75碱基对的U3区通常有一CCAAT系列,在R区前23碱基对的地方,总是有一
,除MMTV外,所有未整合的病毒DNA末端反向重复序列都比整合的前病毒多2个碱基对。在LTR的R区前75碱基对的U3区通常有一CCAAT系列,在R区前23碱基对的地方,总是有一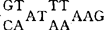 系列(即TATAA盒子),根据细胞基因结核特点推测,这些系列对于转录的启动起重要作用。R系列都是以G开始,这对于病毒RNA的帽子结构形成很重要。另外,R系列结尾总是CA,R-U5交界处之前20bp处有一
系列(即TATAA盒子),根据细胞基因结核特点推测,这些系列对于转录的启动起重要作用。R系列都是以G开始,这对于病毒RNA的帽子结构形成很重要。另外,R系列结尾总是CA,R-U5交界处之前20bp处有一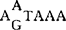 系列,CA和
系列,CA和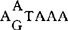 可能都与Poly A形成有关。在R区末端之后10~25bp处的U5内有TTGT或一些密切相关的系列,这些系列可能对病毒RNA合成的终止起重要作用,据推测,靠近U3-R处的反向重复序列也可能对病毒RNA合成的终止起作用。自从Hsu等(1978)首先发现LTR后,对于逆转录病毒的复制机制有了更进一步的了解,越来越多的研究结果发现逆转录病毒的LTR与真核基因的5′和3′末端非编码区具有系列同源性,由此推测LTR可能在宿主细胞RNA聚合酶Ⅱ的作用下发挥其转录启动作用。这一推测后来经过一系列实验得到证实:即对体外或游离的细胞核中的病毒转录体的化学分析,使用RNA聚合酶特异性的抑制剂以及含与外源基因相连的LTR重组子分析。Ju等(1980)通过对克隆的6种不同的禽逆转录病毒DNA的LTR系列分析,并与整合的前病毒比较,发现LTR的结构特征与真核及原核生物的可转位成分很相似,这表明LTR在病毒的整合过程起一定的作用。LTR中含有转录启动子,其作用是受上游的顺式激活系列控制,在DNA转录起始位点下游的顺式激活系列也证明能影响基因表达。在启动子系列中其核心成分就是增强子,有几种逆转录病毒的增强子可以在多种细胞中激活转录(HTLV-Ⅲ等),而另一些病毒这种作用则比较特异,如BLV,HTLV-Ⅰ和Ⅱ的LTR只能在有限的几种细胞内起转录启动作用。HTLV-Ⅲ和HTLV-1的LTR作为一种有效的启动子,其功能并不依赖于病毒相关的反式激活作用,但是,与HTLV-Ⅲ病毒感染相关的因子可以反式激活由HTLV-Ⅰ,Ⅱ的LTR引导的转录。而不激活由BLV或HTLV-Ⅰ,Ⅱ的LTR引导的转录。同样,HTLV-1,Ⅱ或BLV病毒感染也不能反式激活由HTLV-Ⅱ LTR引导的转录和表达。另一种慢病毒CAEV(山羊关节炎脑炎病毒)却缺乏这种反应激活作用,这说明反式激活作用在致病性慢病毒中可能不是一种通性。有实验证明在一个完整的疱疹病毒TK基因的任何一侧连接一个BSV的LTR,再将其注射到体外培养的TK-鼠细胞中,TK基因的转化率可提高20倍。同样,鼠肉瘤(MSV)的LTR也可提高克隆的病毒肿瘤基因(v-mos)的转化效率。通常,病毒RNA合成是从5′末端LTR启动的,3′端的LTR也同样具有启动子作用,当前病毒整合到一个潜在的肿瘤基因邻近的位点时,其3′端的LTR可以启动这种肿瘤基因进行转录,导致肿瘤形成。由ALV引起的淋巴瘤是一个克隆的细胞群,每个肿瘤细胞一般都有多个病毒整合位点,其中至少有一个位点与细胞的肿瘤或相关系到相邻。在多数情况下,整合的前病毒都发生缺失或重排,尽管如此,被严重截短的前病毒对相邻的宿主细胞DNA的表达仍有促进作用。大多数ALV产生的淋巴瘤都携带有前病毒,这些前病毒都是整合在相同的宿主基因组的位点上,而且此位点是与细胞的骨髓瘤基因(c-myc)相邻或在其系列内,前病毒的整合导致c-myc基因转录效率显著升高。从ALV导致的淋巴瘤细胞中分离的DNA可以转化体外培养的NIH3T3鼠成纤维细胞成为肿瘤细胞,但从此淋巴瘤DNA中分离出前病毒及c-myc系列却不能转化NIH3T3细胞。这可能表明ALV导致的肿瘤需要两个步骤:即先对c-myc插入诱变,接着激活其它肿瘤基因重排。根据目前的研究资料,逆转录病毒引起的肿瘤发生机制可归纳为以下3条:(1)前病毒整合在细胞的肿瘤基因附近,其LTR启动相邻的肿瘤基因,使细胞癌变;(2)整合的前病毒被细胞修饰(如缺失或重排),隐含在病毒DNA中的肿瘤基因或相关系列复活;(3)前病毒的整合使细胞的某一基因失活,从而解除了对肿瘤基因的抑制作用。【参考文献】:1 Shimotohno K,et al. Sequence of retrovirus provirus reseb-les that of bacterial transposable elements. Nature (London),1980,285:5502 Temin H M. Structure,variation and synthesis of retrovirus long terminal repeat. Cell ,1981.27:13 Hayward W S, et al. Activation of a cellular oncogene by promoter insertion in ALV - induced lymphoid leukosis. Nature (London) ,1981,290 : 4754 Varmus H E,Form and function of retrovirus provirus science, 1982,216,8125 Temin H M. Function of the retrovirus long terminal repeat. Cell ,1982,28:36 Derse D, et al. Bovine leukemia virus long terminal repeat: A cell type -specific promoter. Science, 1985,227:317
可能都与Poly A形成有关。在R区末端之后10~25bp处的U5内有TTGT或一些密切相关的系列,这些系列可能对病毒RNA合成的终止起重要作用,据推测,靠近U3-R处的反向重复序列也可能对病毒RNA合成的终止起作用。自从Hsu等(1978)首先发现LTR后,对于逆转录病毒的复制机制有了更进一步的了解,越来越多的研究结果发现逆转录病毒的LTR与真核基因的5′和3′末端非编码区具有系列同源性,由此推测LTR可能在宿主细胞RNA聚合酶Ⅱ的作用下发挥其转录启动作用。这一推测后来经过一系列实验得到证实:即对体外或游离的细胞核中的病毒转录体的化学分析,使用RNA聚合酶特异性的抑制剂以及含与外源基因相连的LTR重组子分析。Ju等(1980)通过对克隆的6种不同的禽逆转录病毒DNA的LTR系列分析,并与整合的前病毒比较,发现LTR的结构特征与真核及原核生物的可转位成分很相似,这表明LTR在病毒的整合过程起一定的作用。LTR中含有转录启动子,其作用是受上游的顺式激活系列控制,在DNA转录起始位点下游的顺式激活系列也证明能影响基因表达。在启动子系列中其核心成分就是增强子,有几种逆转录病毒的增强子可以在多种细胞中激活转录(HTLV-Ⅲ等),而另一些病毒这种作用则比较特异,如BLV,HTLV-Ⅰ和Ⅱ的LTR只能在有限的几种细胞内起转录启动作用。HTLV-Ⅲ和HTLV-1的LTR作为一种有效的启动子,其功能并不依赖于病毒相关的反式激活作用,但是,与HTLV-Ⅲ病毒感染相关的因子可以反式激活由HTLV-Ⅰ,Ⅱ的LTR引导的转录。而不激活由BLV或HTLV-Ⅰ,Ⅱ的LTR引导的转录。同样,HTLV-1,Ⅱ或BLV病毒感染也不能反式激活由HTLV-Ⅱ LTR引导的转录和表达。另一种慢病毒CAEV(山羊关节炎脑炎病毒)却缺乏这种反应激活作用,这说明反式激活作用在致病性慢病毒中可能不是一种通性。有实验证明在一个完整的疱疹病毒TK基因的任何一侧连接一个BSV的LTR,再将其注射到体外培养的TK-鼠细胞中,TK基因的转化率可提高20倍。同样,鼠肉瘤(MSV)的LTR也可提高克隆的病毒肿瘤基因(v-mos)的转化效率。通常,病毒RNA合成是从5′末端LTR启动的,3′端的LTR也同样具有启动子作用,当前病毒整合到一个潜在的肿瘤基因邻近的位点时,其3′端的LTR可以启动这种肿瘤基因进行转录,导致肿瘤形成。由ALV引起的淋巴瘤是一个克隆的细胞群,每个肿瘤细胞一般都有多个病毒整合位点,其中至少有一个位点与细胞的肿瘤或相关系到相邻。在多数情况下,整合的前病毒都发生缺失或重排,尽管如此,被严重截短的前病毒对相邻的宿主细胞DNA的表达仍有促进作用。大多数ALV产生的淋巴瘤都携带有前病毒,这些前病毒都是整合在相同的宿主基因组的位点上,而且此位点是与细胞的骨髓瘤基因(c-myc)相邻或在其系列内,前病毒的整合导致c-myc基因转录效率显著升高。从ALV导致的淋巴瘤细胞中分离的DNA可以转化体外培养的NIH3T3鼠成纤维细胞成为肿瘤细胞,但从此淋巴瘤DNA中分离出前病毒及c-myc系列却不能转化NIH3T3细胞。这可能表明ALV导致的肿瘤需要两个步骤:即先对c-myc插入诱变,接着激活其它肿瘤基因重排。根据目前的研究资料,逆转录病毒引起的肿瘤发生机制可归纳为以下3条:(1)前病毒整合在细胞的肿瘤基因附近,其LTR启动相邻的肿瘤基因,使细胞癌变;(2)整合的前病毒被细胞修饰(如缺失或重排),隐含在病毒DNA中的肿瘤基因或相关系列复活;(3)前病毒的整合使细胞的某一基因失活,从而解除了对肿瘤基因的抑制作用。【参考文献】:1 Shimotohno K,et al. Sequence of retrovirus provirus reseb-les that of bacterial transposable elements. Nature (London),1980,285:5502 Temin H M. Structure,variation and synthesis of retrovirus long terminal repeat. Cell ,1981.27:13 Hayward W S, et al. Activation of a cellular oncogene by promoter insertion in ALV - induced lymphoid leukosis. Nature (London) ,1981,290 : 4754 Varmus H E,Form and function of retrovirus provirus science, 1982,216,8125 Temin H M. Function of the retrovirus long terminal repeat. Cell ,1982,28:36 Derse D, et al. Bovine leukemia virus long terminal repeat: A cell type -specific promoter. Science, 1985,227:317(中国农科院哈尔滨兽医研究所童光志博士撰;卢景良审)