【碳立体化学】
拼译:carben stereochemistry
1984年美国E.A.Rohlfihg等在激光气化的石墨蒸气中首次获得比较完整的碳原子簇的飞行时间质谱图(TOF),但试图通过有机合成的方法制备Cn分子的努力尚未奏效。TOF图清楚地表明,在C2~C30范围内,Cn分子以n为奇数时最为稳定(n=3,7,11,15,19,23),间隔为4;而在C40~C120范围内,仅出现核构型为偶数的Cn分子,且其丰度分布近似于以C60为最稳定结构的高斯分布。此图发表不久,英国H.W.Kroto和美国R.E.Smalley等(1985)很快通过改变簇化条件得到以C60占绝对优势的Cn原子簇分布。其质谱图中,C60峰强是C70的10倍,是相邻其它峰的40倍之多。为了解释C60的高度稳定性,Kroto等大胆地提出了著名的碳球假设,即C60具有五元和六元碳环相间分布连接而成的空心球状结构。其后大量理论计算表明碳球假设是C60结构的最合理描述,但人们一直未能从实验上制备出宏观量的稳定C60样品。1990年底,德国W.Kratschmer和美国D.R.Huffman等首次成功地从石墨放电产生的松烟中分离出主要含有C60(含少量C70)的固体样品,并测定了其X-射线和电子衍射光谱;与此同时,Kroto领导的英国Sussex大学研究小组首次实现了C60与C70的色谱分离,并且测定了其纯样品的质谱、核磁、红外、紫外光谱。至此,人们制得了除网状的金刚石和层状的石墨之外的第3种形式碳——球状碳。各种制备条件和电离化技术已经证明,比较稳定的碳原子簇存在一个幻数序列:C24,C28,C32,C36,C50,C60,C70,C84…等。其中,C60最稳定,C70次之,C50再次之。这些碳原子簇分子均具有由五元和六元碳环彼此相连构成的空心笼状结构,统称为富勒烯。C60的发现开辟了碳化学研究的新领域。
Cn分子的核构型由线状、环状(n<20)向球状以及单质碳由层状、网状向球状分子的密堆积的结构变化,反映了元素由单个原子X,经过原子簇Xn的结构过渡,核构型逐渐向稳定单质的固体结构X变化的典型图象。C[2s22p2]是周期表中第4主族的第1个元素。与本族其它元素相比,在成键性能方面具有明显特性。由于2s,2p轨道能量相近,原子易于形成sp,sp2及sp3杂化轨道,所剩余未饱和的P轨道也极易与相邻原子的P轨道形成离域性大π键。典型的例子是金刚石(sp3)及石墨晶体(sp2)中的成键。这些特性在Cn原子簇的几何构型和电子结构中也得到充会体现。C2~C20范围之内的分子只在极端条件下的蒸气相中观察到。虽然已经得到部分分子的振动光谱,但对其结构研究还基本停留在量子力学计算水平上。当n为奇数时,Cn分子的基态是单重态的多烯直线状分子,如C3为:C=C=C∶;C5为∶C=C=C=C=C∶等。显然,C的sp杂化轨道和线状大π键的形成是维系其线性结构的根本因素。当n为偶数时,Cn分子稳定基态是平面环形结构。这里正n边形已发生畸变,n重轴消失,Cn分了点群为Dmh(m=n/2),以形成更有效的大π键。其中,C4为一双环结构(其菱形结构的短轴方向存在微弱双键,其余均为单环。从头计算还表明,线状C8,C6,尤其是C4也相当稳定,如线型C4(∶C=C=C∶)与环状C4几乎是等能量异构体。在这些分子的电子结构中,形成了覆盖于环上下两方的环形离域大π键。当n大于等于10时,Cn倾向于形成环状结构,预计较稳定的核构型为C11,C15,C19及C23等,满足4m-1规则。值得指出的是,由于光离化过程的影响,TOF的质谱分布可能有所不同。另外在n=30~40范围内,Cn质谱峰消失。这一区域被称为碳原子簇的“死寂区”,其结构机制尚不清楚。大的碳原子簇Cn(n>40)中,C60是典型代表。可以对碳原子簇Cn进行结构分区:C2~C3:稳定线性结构区,sp杂化;C10~C28:稳定单环结构区,sp2杂化;其间,C4~C9实现两区间的结构过渡。可以想见,随着n的增大,单环的柔性增加,环上原子偏离对称面,沿环分布的大π键遭到破坏,体系稳定性降低,因而出现C30~C40范围内Cn结构上的“死寂区”。进一步增加碳原子数,因环波皱折而偏离环平面的碳原子之间,甚至是环对面的碳原子之间,可能直接成键,以至闭合成笼,这样不仅增加了σ键(sp2杂化)的数目,而且原来沿环分布的大π键可以进一步贯通,形成覆盖笼状结构内外两侧的球面(或畸变的球面)离域兀键。显然,这一超共轭键的稳定化作用将随碳球骨架的张力分布而变化。表面曲率均一、张力最小的空心笼状结构将产生最稳定的Cn分子,它便是C60。据此,可以划出Cn结构分布的第3区。C40~C100:稳定碳球结构区,sp2。在此之前的C30~C40则是单环结构与球状结构的过渡。C60是在石墨蒸气中经氦气(100 Torr)冷聚形成的。在六元稠环的相互融合并最后形成闭合的球形的过程中,必须引进五元环,这是由欧拉网闭合条件决定的。12=3n3+2n4+1n5+0n6-1n7-2n8… (1)
其中,nk为k元环的数目。对碳来说。六元环最稳定,五元环次之,四元和七元则极不稳定。所以(1)式中,六元的数目不受限制,而12个五元环是必需的。
空心笼状结构的稳定存在有赖于沿其表面分布的离域兀键的形式。在球面曲率越大的地方,由于相邻碳原子的p2轨道的不平行度增大,兀键越弱,甚至出现阻断,导致碳球破裂。构造碳球系列的一般原则可以总结如下:碳球表面只由五元环和六元环组成;闭壳层电子结构原则;芳香性原则;表面张力对称分布原则;五元环尽可能不相邻原则;欧拉网闭合条件原则(1),即最少含有12个五元环,六元环数目不受限制。C60是唯一能够满足所有这些条件、对称性最高(Ih),且所有碳原化学上等价的Cn分子,它也是能够满足成键要求和美学标准的最经济分子。C60具有20个六元环,12个五元环,只要在足球球面的12个黑色五边形的顶点上各放置一个碳原子,便是C60的形象。在C60表面上有两种C-C键长:由相邻六元环共用的键略短r6-6=1.40×10-10m,而由五元和六元环共用键略长r6-5=1.46×10-10m(Jr.W.Wilson等,1990)。根据以上原则,可以构造整个碳球系列:C24,C28,C32,C50,C60,C70,C84等。其中C60最稳定,是第1个可以避免两上五元环相连的最小分子;C70在轴向略有拉长,状似橄榄球,性质次稳定;C50再次之,它是可以避免3个五元环相连的最小分子;C28是第一个可以避免4个五元环相连的最小分子;C20为最小可能存在的中空笼分子。C60及C70的实验室制备及光谱性质测定(红外,紫外,核磁,质谱,X-射线,中子射线及电子射线衍射和电镜扫描谱)均在1990年底1991年初完成。虽然未能制得长程有序的C60分子单晶,因而无法精确测定其键长、键角等分子结构参数,但碳球假设已确信无疑,而且电镜扫描亦已直接拍摄了球状C60和椭球C70的照片(R.J.Wilson,1990)。C60和C70键参数的最终测定只是一个时间问题。从研究进展来看,C60和C70在有机、无机合成及材料科学的许多领域,已展现出令人鼓舞的前景。六方密堆积(hcp,a=10.02×10-10m,c=16.36×10-10m)、面心立方(fcc,a=14.198×10-10m)和更普通存在的多晶C60是C60的稳定存在形式。在前两种密度堆积形式中,C60与最邻近C60的球心间距约为10.02×10-10m。理论估计C60球的分子直径约为7.1×10-10m(H.W.Kroto等,1985)因而在晶体中C60球面间的距离约为3.1×10-10m,比石墨层间距3.35×10-10m略短。理论计算表明,面心立方C60晶体的单分子结合能仅为约1.6ev,可见C60分子晶体依赖于微弱的范德华力维系。S.Susumu等(1991)的研究还表明,fcc C60是一种能隙为1.5ev的半导体材料。C60的空腔(R≈7.1×10-10m)可以容纳各种金属离子,形成包合物C60Mn+;其表面上高度未饱和的碳原子又可能与各种有机或无机基团连接,形成结构特殊、功能奇异的分子。因而C60可以像分子反应器一样,充当化学合成的底物。据报道,C60K+,C60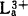 及C60Ca2+等均已合成出来,并具有较好的超导性能;北京大学已合成了Tc值为37K的C60Sn超导体。美国加州大学伯克利分校则已测定了C60OO4·(4-MeC-C5H4N)2加合物的单晶结构,其中,OsO4的两个氧原子加成到C60表面的两个毗邻碳原子C1、C2上,但C1-C2键并未断裂;碳球上其余C-C键的平均键长为r6-6=1.388×10-10m,r6-5=1.421×10-10m。另外,C60F60氟化物可能是一种高温润滑剂(H.W.Kuoto等,1985)。C60可以被氢化为C60、H36及C60H18,后者又可以可逆地被氧化为C60;循环伏安法研究表明,C60可高度可逆地转化为C60-和C602-。这一反应可能为新一代可逆电池提供原料。C60本身是在模拟星际空间的碳化学反应的过程中发现的。据息,C60或其衍生物广泛存在于富碳星附近;另外,碳球还可能存在于人类生活的各个角落,因为碳球与火源伴生。
及C60Ca2+等均已合成出来,并具有较好的超导性能;北京大学已合成了Tc值为37K的C60Sn超导体。美国加州大学伯克利分校则已测定了C60OO4·(4-MeC-C5H4N)2加合物的单晶结构,其中,OsO4的两个氧原子加成到C60表面的两个毗邻碳原子C1、C2上,但C1-C2键并未断裂;碳球上其余C-C键的平均键长为r6-6=1.388×10-10m,r6-5=1.421×10-10m。另外,C60F60氟化物可能是一种高温润滑剂(H.W.Kuoto等,1985)。C60可以被氢化为C60、H36及C60H18,后者又可以可逆地被氧化为C60;循环伏安法研究表明,C60可高度可逆地转化为C60-和C602-。这一反应可能为新一代可逆电池提供原料。C60本身是在模拟星际空间的碳化学反应的过程中发现的。据息,C60或其衍生物广泛存在于富碳星附近;另外,碳球还可能存在于人类生活的各个角落,因为碳球与火源伴生。(山西运城高等专科学校李思殿教授撰)