【酶免疫分析技术在农药分析领域的应用】
农药及其代谢物的酶免疫分析是一项新技术,它具有快速、灵敏、费用低和适于现场检测等优点。国外已开发出多种农药的酶免疫分析方法,其中包括均相酶免疫分析和非均相酶免疫分析,分析时间从几秒钟到几小时,检测灵敏度为10-9g,有些甚至可测定到10-12g。单克隆抗体已开发成功。酶免疫分析技术与常规理化分析方法比较有许多突出的优点,因此越来越受到人们的重视。 任何免疫学分析的基本原理都是以抗原与抗体的特异性结合为基础的。为了揭示微量抗原与抗体的免疫学反应需要引入一个示踪物。通常使用的示踪物有放射性同位素、酶和荧光素。根据示踪物的不同,分别称为放射免疫测定(RIA)、酶免疫测定(EIA)和荧光免疫测定(FIA)。1982年以前,农药和其它环境污染物分析多使用RIA法。由于RIA法需要昂贵的仪器和使用有危险的放射性同位素,因此应用受到一定限制。FIA法虽然比较便宜,示踪物也较稳定,但由于对样品背景的干扰敏感,因而在农药分析中很少使用。由于EIA的稳定性和灵敏度,自1983年以后在农药分析中使用的几乎都是EIA法,尤其是酶联免疫吸附剂测定法(ELISA)应用得更广泛,现在已成为首选的方法。酶免疫分析的基本类型 目前尚无统一的分类方法,参照国外有关文献和国内惯用名称,考虑到农药分析的特点,列出下面几种主要的类型。
酶免疫分析的基本原理1.均相EIA原理。均相EIA不用固相载体作为吸附剂,测定中不需分离结合的与游离的酶标记物。其特点是检测时只需微量样品(μl),且能在2~45min内出结果。目前临床上多用于测定某些药物等小分子物质,其原理是某些酶与半抗原结合后酶活性不受影响。而酶标记的半抗原与相应的抗体结合时酶活性降低或增加,通过测定酶活性的改变,便可以知道抗原量。2.非均相EIA原理。非均相EIA是目前使用最广泛的一种免疫学方法。它需要分离结合的与游离的酶标记物。根据分离方法不同分为液相法和固相法,后者简便易行、使用极广,而前者在农药分析中未见应用。固相EIA借助于固相载体的吸附人生用使游离的与结合的酶标记物分离,主要有直接法和间接法两种类型。(1)直接法原理。直接法是抗原与抗体发出反应后,直接进行显色的非均相固相免疫分析法。固相抗原与待测的游离抗原竞争有限量的酶标记抗体,反应后洗去可溶性的游离抗原与抗体的结合物,测定固相抗原与抗体结合物上的酶活性,可得到待测抗原的量,酶反应活性与待测抗原的量成负相关。酶标抗原与待测抗原竞争有限量的固相抗体,反应后测定固相抗体与酶标记的抗原结合物上的酶活性,活性强度与待测抗原浓度成负相关。(2)间接法原理。间接法是固相抗原与待测游离抗原竞争有限量的抗体(称第1抗体),反应后洗去游离的结合物,然后再加入酶标记第2抗体(以第1抗体为抗原的酶标抗体),反应后测定结合物的酶活性,活性强度与待测抗原浓度成负相关。直接法分析速率较间接法快,但酶与样品接触,易受杂质干扰。间接法可以避免杂质对酶的干扰,不需要自己合成酶标记物,故使用最广。开发酶免疫分析的程序1.抗原的合成。农药是小分子化合物(称为半抗原),必须共价结合到一个大分子载体(通常为蛋白质)上,以结合物作为免疫原。半抗原与蛋白质结合的基本要求是半抗原分子中有一个活性集团,如氨基、羧基、羟基或酮基。必要时可通过化学反应在半抗原分子上引入一个活性集团或使用半抗原的某种代射产物。根据半抗原上的活性集团物质与蛋白质结合的方法。通常使用的方法有:(1)碳二亚胺(EDC)法。反应式中Hp和Pr分别代表半抗原和蛋白质。半抗原上的羧基先与EDC反应生成一个中间物,然后再与蛋白质上的氨基反应,生成半抗原与蛋白质的结合物。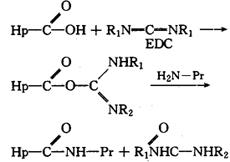
(2)混合酸酐法。半抗原上的羧基在正丁胺存在下与氯甲酸异丁酯反应,形成混合酸酐的中间体,再与蛋白质的氨反应,形成半抗原与蛋白质的结合物。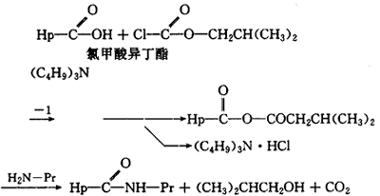
(3)戊二醛法。戊二醛的两个醛基分别与半抗原和蛋白质上的氨基形成Schiff键(-N=C<),在半抗原与蛋白间引入一个5C桥。 Hp-N=CH(CH2)3CH=N-Pr+H2O(4)重氮化法:半抗原上的芳香胺基与NaNO2和HCl反应得到一个重氮盐,它可直接接到蛋白质酷氨酸残基的邻位上,形成一个偶氮化合物。 Hp-N=CH(CH2)3CH=N-Pr+H2O(4)重氮化法:半抗原上的芳香胺基与NaNO2和HCl反应得到一个重氮盐,它可直接接到蛋白质酷氨酸残基的邻位上,形成一个偶氮化合物。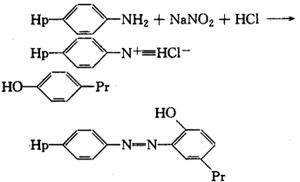
(5)琥珀酸酐法。半抗原的羟基与琥珀酸酐在无水吡啶中反应得到一个琥珀酸半酯,再经碳二亚胺法或混合酸酐法与蛋白质氨基结合。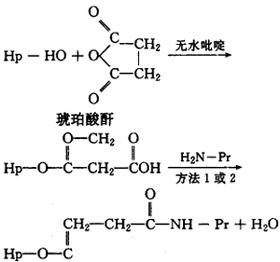
(6)O-(羟甲基)羟胺法。半抗原的酮基与O-(羟甲基)羟胺反应得到一个羧甲肟衍生物,再经碳二亚胺或混合酸酐法与蛋白质氨基结合。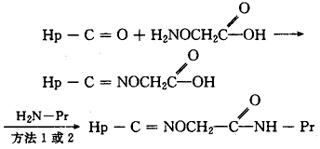
上面提到的蛋白质通常使用牛血清白蛋白(BSA),人血清白蛋白(HSA),兔血清白蛋白(RSA)、钥孔血蓝蛋白(KLH)和卵清蛋白(OA)。李治祥等在开发对硫磷ELISA方法时,将对硫磷先还原成氨基对硫磷,然后通过重氮化反应与BSA或RSA结合。前者作为免疫原,后者作为所被抗原,得到了满意的结果。2.免疫动物制备抗体。制备小分子化合物的抗体一般选用兔子作为免疫动物。注射途径有皮下、肌肉、皮内和静脉。最好同时选用两条注射途径,单一注射途径难以获得小分子化合物的抗体。通常第一次注射时,将溶有一定量抗原的生理盐水与等体积的弗氏完全佐剂混合后注射。间隔一定时间加强注射时使用不完全佐剂。一般在每次注射后8~12d采血,分离血清,测定抗体滴度和特异性,当二者均达到要求时,大量采血,血清冻干后,低温下可保存数年。3.实验条件选择。一旦获得了特异性抗体,便可用于开发EIA方法,通常使用最多是ELISA方法,要获得最高分析灵敏度,必须精心选择最佳实验条件。影响ELISA分析灵敏度的因素很多,如吸附材料、包被抗原浓度、抗体稀释度、温育时间等。通常使用的吸附材料为96孔聚苯乙烯微量反应板,它应具有最大限度吸附蛋白的能力和最小的孔向差异性。包被抗原与免疫原结构可能会影响分析的特异性和灵敏度。因此最好使用不同的合成路线和不同的蛋白质来合成包被抗原和免疫原。4.样品制备。由于EIA方法的测定是在水相中进行的,抗体和酶活性易受有机溶剂的影响,加之免疫分析具有同时测定大量样品的特点,因此样品的制备方法需要专门开发。对土壤、动植物样品,选用有一定渗透能力且易挥发的有机溶剂提取较为理想。这样既可提高提取效率,又可使提取溶剂易于挥发去除,以满足在水相中测定的需要。使用丙酮、甲醇等极性大的溶剂提取,虽然提取效率高,但提取出来的水溶性杂质多,对测定易造成较大影响。为了避免溶剂挥发过快造成样品损失,可在提取液中加入少量的潜溶剂,如甲醇、乙醇,丙二醇、二甲亚砜、乙腈、四氢呋喃、二烷等,让提取溶剂在潜溶剂表面挥发,可有效地减少样品损失。如在提取液中加入少量丙二醇,使用苯在丙二醇表面挥发,可减少草达灭的损失。另一种提取方法是使用易挥发的戊烷,戊烷极性差,难以渗入样品中去,因此提取时需加适量极性大的二氯甲烷,提取后两种溶剂在丙二醇表面挥发。当戊烷和二氯甲烷的比例从8∶2到0.5∶9.5时,草达灭的提取效率从(66.9±3.2)%,提高到(94.7±0.2)%(J.Fleeker,1987)。由于抗体的差异性较大,所选用的潜溶剂对一种方法没有影响,而可能降低或提高另一方法的灵敏度。一般来说,在脂溶性化合物的免疫分析系统中加入少量潜溶剂可减少基质的影响。5.酶免疫分析方法的确定。通常是将所开发的EIA方法与现有的常规分析方法,如气相色谱法进行比较研究。在2种方法进行比较时需注意以下几个问题。在大多数情况下,免疫分析样品制备程序较简单,不需净化,花费时间少。因此应及时处理样品、避免样品生物转化、挥发、化学降解或其它随时间变化而变化的因素给结果带来的影响。试验设置重复对保证结果的可靠性是必要的。如ELISA分析结果是将每个样品做一系列稀释,每个稀释度重复4次而获得的。测定新的样品时应注意基质的影响,尤其是差异性较大的环境样品,仅研究少量样品可能会导致错误的结果。越来越多的资料表明,人们对农药和其它环境污染物的酶免疫分析的兴趣在不断增加,应用的范围也在不断扩大。除用于农药及其代谢物的分析外,也已用于其它污染物的分析,如多氯联苯、二英、天然真菌毒素、抗菌素、添加剂等,再已证明酶免疫分析具有广泛的实用性。某些新农药,特别是常规方法难以测定的农药及其代谢的酶免疫分析方法正在开发之中。使用酶联免疫分析和更多的使用均相酶免疫分析将会不断增加。这是由于其高度的重现性和短的分析时间所决定的。抗体结合到一种固体支持物上可以做为亲合柱用于浓缩大体积水中的农药,然后洗下来进行分析。甚至大型柱可以用于水的净化,以去除农药等污染物。Lmmunosystems inc 1991年已生产出了几种农药检测箱,其中包括杀虫剂、杀菌剂和除草剂。这种检测箱配上便携式分光光度计可实现田间定量测定。检测灵敏度为0.03~25ng/kg,检测的样品有食品乙腈提取物,但主要是水的样品。开发免疫检测箱的费用高,但直到这类检测箱成为商品销售之后,免疫分析才会成为常规分析方法。我们希望看到一些实验室开发的方法能够尽快得到应用和商品化。单克隆抗体的生产和应用将得到不断扩大,因为这样就可以在需要的时候获得无限量的抗体,然而并不排斥多克隆抗体的开发的应用。使用简单仪器或标准比色板的酶免疫分析技术在发展国家的应用将会越来越受到重视。因为通常这些国家缺乏专业技术人员,而酶免疫分析费用低、操作简单,这些国家更容易接受。正在开发的一些生物来源的大分子农药,使用气相色谱等常规分析方法定量有困难,而酶免疫分析可选择使用的方法。酶免疫分析将会得到更快的发展。(农业部环境保护科学研究所李治祥、张俊亭、王勇撰) |



 Hp-N=CH(CH2)3CH=N-Pr+H2O(4)重氮化法:半抗原上的芳香胺基与NaNO2和HCl反应得到一个重氮盐,它可直接接到蛋白质酷氨酸残基的邻位上,形成一个偶氮化合物。
Hp-N=CH(CH2)3CH=N-Pr+H2O(4)重氮化法:半抗原上的芳香胺基与NaNO2和HCl反应得到一个重氮盐,它可直接接到蛋白质酷氨酸残基的邻位上,形成一个偶氮化合物。

