【空泡膜类型H+-ATPase】
已知的膜质子泵ATPase有3种:质膜E1E2类型的P-ATPase;线粒体(或称真细菌)F1F。类型的F-ATPase,即ATP合成酶;空泡膜类型的V-ATPase,核类型ATPase广泛地存在于真核细胞的高尔基体、内质网、溶酶体、嗜铬颗粒、笼蛋白衣被小泡以及植物和酵母的液泡膜上,是研究较多的一类新型质子泵ATPase(N.J.Nelson等,1989),F和V-ATPase在结构和生化性质方面有许多相似之处,但这是两种不同类型的质子泵ATPase(Y.Wang等,1985),在真核细胞中,酵最根本的区别在于酶复合物中各种亚基的基因分布,VATPase所有亚基的基因都分布在核DNA,F-ATase亚基的基因,有些在核DNA而另一些在细胞器DNA中。植物液泡膜H+-ATPase与所有的V-ATPase有类似的结构,J.M.Ward和H.Sze(1992年)的工作证明了这一点。他们采用Sephacrv 1 S-400凝胶过滤和Q-Sepharose离子交换的方法纯化燕麦根液泡膜H+-ATPase,经SDS-PAGE9%~15%的梯度分离,结果表明这个分子量为650kD的ATPase,由10种多肽组成,用KI和Mg2+-ATP溶液处理液泡膜微囊,释放出70、60、44、42、36和29kD的多肽,留在膜上的多肽并无水解ATP和泵质子的活性,这说明释放出的多肽为膜的外周蛋白。J.M.Ward和H.Sze提出的燕麦根液泡膜的结构模式图中,70kD的多肽为酶的催化部位,60kD的多肽为底物结合部位,16和13kD的两条多肽与膜脂结合形成脂蛋白,16kD的多肽可与DCCD(二环乙基碳二亚胺)结合,可能参与质子通道的形式。在嗜铬颗粒膜H+-ATPase的结构模式图中,它与溶酶体膜H+-ATPase有类似的亚基结构,水溶性部分有5五种多肽,脂溶性部分有16和20kD两条多肽与膜结合形成脂蛋白,39和115kD的两条多肽为附属亚基,溶酶体丰富的细胞含有大量可翻译为39kD多肽的mRNA,对编码这条多肽的基因已进行了克隆和序列分析(Y.Moriyana等1987)。目前在溶酶体膜H+-ATPase中尚未找到115kD的多肽,是否所有的V-ATPase分子中都含有这种高分子量的附属亚基,尚未定论。1992年M.S.Perin等人提出,高分子量的附属多肽应是各种来源的V-ATPase的共同成分,他们从笼蛋白衣被小泡H+-ATPase中分离出包括116和38kD在内的9条多肽,确定116kD的多肽由838个氨基酸残基组成,全肽分为两部分,氨基端一半含条水氨基酸残基多,这段疏水肽段多次跨膜折叠,根据疏水度推断跨膜片段的氨基酸序列和残基数(S.M.Perin等,1991)。
液泡膜H+-ATPase最明显的特征是被硝酸盐抑制和阴离子激活,对于燕麦根液泡膜H+-ATPase来说,各种单价阴离子激活的顺序为:Cl-,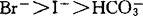 ,对叠氮盐和钒酸盐不敏感(Y.Wang等,1985)。液泡膜H+-ATPase的催化机理E.Uchida等用酵母在稳态和非稳态两种条件下作了研究。稳态条件下,反应混合液中有过量的ATP存在,酶催化ATP的水解采取多向循环路线非稳态条件下,反应液中仅有少量的ATP32,ATP的水解路线为单向循环。ATP首先与对NBD-Cl敏感的催化部位结合形成酶-ATP复合物,水解ATP生成的ADP和Pi先后从酶分子上释放出来,如果有过量的ATP存在,ATP作为正效应物激活催化部位,进行多向循环路线形成nATP.
,对叠氮盐和钒酸盐不敏感(Y.Wang等,1985)。液泡膜H+-ATPase的催化机理E.Uchida等用酵母在稳态和非稳态两种条件下作了研究。稳态条件下,反应混合液中有过量的ATP存在,酶催化ATP的水解采取多向循环路线非稳态条件下,反应液中仅有少量的ATP32,ATP的水解路线为单向循环。ATP首先与对NBD-Cl敏感的催化部位结合形成酶-ATP复合物,水解ATP生成的ADP和Pi先后从酶分子上释放出来,如果有过量的ATP存在,ATP作为正效应物激活催化部位,进行多向循环路线形成nATP.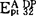 复合物,既可以先释放出nATP,也可以先释放出ADP和
复合物,既可以先释放出nATP,也可以先释放出ADP和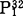 。在两种情况下,NBD-Cl都有抑制作用,它的作用是使催化部位失活,阻止酶-ATP复合物的形成,只有在ATP过量时,DCCD才有抑制作用,DCCD不影响酶与ATP的结合,这种催化机理模式与线粒体H+-ATPase的催化机理类似(C.Grubmeyer等,1983;M.Futai等,1988。为了说明液泡膜H+-ATP分子中与膜脂结合的小分子多肽在水解ATP中的作用,R.Hirara等(1989年)采用放射性失活分析法(radiarion inactivarion analysis),把液泡膜微囊置于Co60γ射线下照射,两种ATP水解路线都受到抑制。对射线照射的敏感性,单向循环比多向循环多4倍,采取靶理论的方法,测定参与单、多向循环的多肽,其分子量分别为0.9~1.1×103和4.1~5.3×105D这说明在单向循环中只需要V-ATPase的A和B两个亚基参加,在多向循环中,V-ATPase必需有适当的寡聚结构,即(A,B)mCn,C代表与膜结合的多肽组分,其中m不小于3,在这种情况下,ATP水解与泵质子过程偶联,受DCCD的抑制。V-ATPase的各亚基基因克隆和序列分析工作进行的较晚。萝卜、脉孢杆菌和酵母液泡膜ATPase的A、B、亚基基因的序列分析已经完成,各种V-ATPase A,亚其的氨基酸序列测定有许多报道,结果表明,不同来源的V-ATPase亚基之间表现出极大范围的同源性(B.J.Boowmam等,1988;N.Nelson等,1989)。表1列出了F-ATPase的α,β亚基与各种V-ATPase的A,B亚基之间,相同氨基酸序列所占的百分比,可以清楚地看出,高等植物与真菌V-ATPase的亚基之间,相同的氨基酸序列占整个亚基总氨基酸的60%左右,B亚基更保守的约占70%,古细菌和真菌、高等植物的V-ATPaseA,B亚基之间的相同氨基酸序列约占50%,F-与V-ATPase之间的同源性表明,A与β,B与α之间的较密切的关系(N.Nelson等,1989)。根据分子遗传学的研究,普遍认为F-和V-ATPase在进化上有密切的亲缘关系,在F-和V-ATPase中两个大亚基的进化过程中,70kD的祖先H+-ATPase基因中含有编码ATP结合位点的GXXGXGKT氨基酸序列,这段序列在V和F-ATPase的A亚基和B型亚中都可找到。V-ATPasr的催化组分中,仅对E亚基进行了序列测定,它与F-ATPase的γ、δ和ε亚基均无相同的氨基酸序列,即无同源性。这说明γ、δ和ε是ATP合成酶所必需的功能肽,V-ATPase的D和E亚基是细胞器内酸化所必需的功能肽,这些亚基部是进化过程中后来加上去的(S.Hirsch等,1988)。编码牛嗜洛颗粒膜和酵母液泡膜V-ATPase的脂蛋白基因已经克隆,并进行了序列测定(V.P.Richard,1988)。在具有ATP合成酶功能的F-ATPase和古细菌的V-ATPase分子中,都有δkD的祖先脂蛋白基因产物。真核细胞中,V-ATPase的16kD的脂蛋白是ATP合成酶演变为具有质子泵功能,不再具有ATP合成酶功能的重要标志(M.Mandel等,1988)。K.Puopolot等(1990)使用各种技术对笼蛋白衣被小泡H+-ATPase进行结构分析,结果发现V-和F-ATPase的拓扑结构非常类似,在ATP或Mg2+-ATP存在的情况下,用促溶剂(如Kl、KNO2等)处理这两种酶,可溶性多肽从膜上离解下来,从V-ATPase上下来的多肽有73,58,40,34和33kD,被称之为V1,留在膜上的100,38,19和17kD的多肽,被称之为V2。两者的差别是:F1具有水解ATP的活性,V1则丧失了这种活性。深入的分子遗传学研究仍在进行。对于在植物细胞内离子平衡起中心调节作用的液泡来说,液泡膜H+-ATPase起着关键作用,日本学者Y.Ohya等人研究酵的Ca2+敏感cis系列突变体时发现,不能利用甘油、乳酸、琥珀酸等作碳源的pet-表现型,细胞内维持Ca2+的研究证明,Pet-表现型是由于液泡膜H+-ATPase的各亚基有不同程度的损伤,丧失了酸化液泡内环境的能力,导致Ca2+转运受阻(Y.Ohya等,1991)。V-ATPase在酸化细胞内各种细胞器内环境的过程中起重要作用,这种酸化作用为细胞内各种生理系列化反应提供了必要的条件,因此VATPase的深入研究对于医学和农业生产具有重要的理论和实际意义。
。在两种情况下,NBD-Cl都有抑制作用,它的作用是使催化部位失活,阻止酶-ATP复合物的形成,只有在ATP过量时,DCCD才有抑制作用,DCCD不影响酶与ATP的结合,这种催化机理模式与线粒体H+-ATPase的催化机理类似(C.Grubmeyer等,1983;M.Futai等,1988。为了说明液泡膜H+-ATP分子中与膜脂结合的小分子多肽在水解ATP中的作用,R.Hirara等(1989年)采用放射性失活分析法(radiarion inactivarion analysis),把液泡膜微囊置于Co60γ射线下照射,两种ATP水解路线都受到抑制。对射线照射的敏感性,单向循环比多向循环多4倍,采取靶理论的方法,测定参与单、多向循环的多肽,其分子量分别为0.9~1.1×103和4.1~5.3×105D这说明在单向循环中只需要V-ATPase的A和B两个亚基参加,在多向循环中,V-ATPase必需有适当的寡聚结构,即(A,B)mCn,C代表与膜结合的多肽组分,其中m不小于3,在这种情况下,ATP水解与泵质子过程偶联,受DCCD的抑制。V-ATPase的各亚基基因克隆和序列分析工作进行的较晚。萝卜、脉孢杆菌和酵母液泡膜ATPase的A、B、亚基基因的序列分析已经完成,各种V-ATPase A,亚其的氨基酸序列测定有许多报道,结果表明,不同来源的V-ATPase亚基之间表现出极大范围的同源性(B.J.Boowmam等,1988;N.Nelson等,1989)。表1列出了F-ATPase的α,β亚基与各种V-ATPase的A,B亚基之间,相同氨基酸序列所占的百分比,可以清楚地看出,高等植物与真菌V-ATPase的亚基之间,相同的氨基酸序列占整个亚基总氨基酸的60%左右,B亚基更保守的约占70%,古细菌和真菌、高等植物的V-ATPaseA,B亚基之间的相同氨基酸序列约占50%,F-与V-ATPase之间的同源性表明,A与β,B与α之间的较密切的关系(N.Nelson等,1989)。根据分子遗传学的研究,普遍认为F-和V-ATPase在进化上有密切的亲缘关系,在F-和V-ATPase中两个大亚基的进化过程中,70kD的祖先H+-ATPase基因中含有编码ATP结合位点的GXXGXGKT氨基酸序列,这段序列在V和F-ATPase的A亚基和B型亚中都可找到。V-ATPasr的催化组分中,仅对E亚基进行了序列测定,它与F-ATPase的γ、δ和ε亚基均无相同的氨基酸序列,即无同源性。这说明γ、δ和ε是ATP合成酶所必需的功能肽,V-ATPase的D和E亚基是细胞器内酸化所必需的功能肽,这些亚基部是进化过程中后来加上去的(S.Hirsch等,1988)。编码牛嗜洛颗粒膜和酵母液泡膜V-ATPase的脂蛋白基因已经克隆,并进行了序列测定(V.P.Richard,1988)。在具有ATP合成酶功能的F-ATPase和古细菌的V-ATPase分子中,都有δkD的祖先脂蛋白基因产物。真核细胞中,V-ATPase的16kD的脂蛋白是ATP合成酶演变为具有质子泵功能,不再具有ATP合成酶功能的重要标志(M.Mandel等,1988)。K.Puopolot等(1990)使用各种技术对笼蛋白衣被小泡H+-ATPase进行结构分析,结果发现V-和F-ATPase的拓扑结构非常类似,在ATP或Mg2+-ATP存在的情况下,用促溶剂(如Kl、KNO2等)处理这两种酶,可溶性多肽从膜上离解下来,从V-ATPase上下来的多肽有73,58,40,34和33kD,被称之为V1,留在膜上的100,38,19和17kD的多肽,被称之为V2。两者的差别是:F1具有水解ATP的活性,V1则丧失了这种活性。深入的分子遗传学研究仍在进行。对于在植物细胞内离子平衡起中心调节作用的液泡来说,液泡膜H+-ATPase起着关键作用,日本学者Y.Ohya等人研究酵的Ca2+敏感cis系列突变体时发现,不能利用甘油、乳酸、琥珀酸等作碳源的pet-表现型,细胞内维持Ca2+的研究证明,Pet-表现型是由于液泡膜H+-ATPase的各亚基有不同程度的损伤,丧失了酸化液泡内环境的能力,导致Ca2+转运受阻(Y.Ohya等,1991)。V-ATPase在酸化细胞内各种细胞器内环境的过程中起重要作用,这种酸化作用为细胞内各种生理系列化反应提供了必要的条件,因此VATPase的深入研究对于医学和农业生产具有重要的理论和实际意义。(武汉大学王延枝教授、许献忠撰)